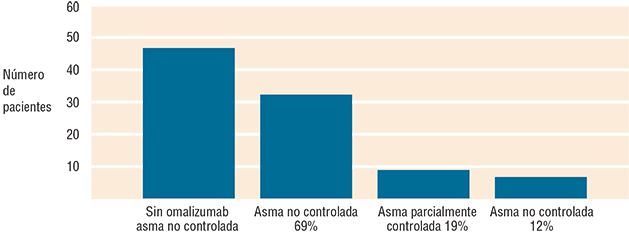
Figura 1. Resultados del tratamiento con omalizumab.
ARTÍCULO ORIGINAL
Jorge Bernardo Vargas-Correa,1 Raúl Bracamonte-Peraza,1 Sylvia Marcela Espinosa-Morales,1 Francisco Vázquez-Nava2
1Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Hospital Regional Mérida, Coordinación de Medicina Interna. Mérida, Yucatán. México
2Universidad Autónoma de Tamaulipas, Campus Tampico-Madero, Facultad de Medicina de Tampico “Dr. Alberto Romo Caballero”. Tampico, Tamaulipas, México
Background: Omalizumab is a monoclonal antibody that is prescribed in a stepwise addition regimen for the treatment of severe asthma.
Objectives: To report the experience of patients with severe asthma who were given omalizumab in accordance with international guides, in a context of real-world data.
Methods: Open, analytical, cross-sectional, retrospective, observational clinical study with real-world data. GINA 2006 Asthma Control Scheme was used to evaluate patients, and a questionnaire was used to evaluate patient characteristics, effectiveness, safety, and tolerance to omalizumab.
Results: 48 patients were studied, 34 women and 14 men with an average age of 39 years. The average disease duration was 26 years. Average serum IgE was 522 IU. At the beginning of treatment, all patients had uncontrolled asthma; at the end, 69% asthma control was obtained, 19% was partially controlled and 12% unchanged. The changes were observed at seven months on average.
Conclusion: Omalizumab is effective and safe for treating severe asthma when applied in accordance with international guidelines for the management of bronchial asthma.
Keywords: Omalizumab; Asthma; Management Stepwise; Real World Data.
Este artículo debe citarse como: Vargas-Correa JB, Bracamonte-Peraza R, Espinosa-Morales SM, Vázquez-Nava F. Experiencia clínica con omalizumab en pacientes con asma severa. Datos del mundo real. Rev Alerg Mex. 2016;63(3):216-226
Antecedentes: El omalizumab es un anticuerpo monoclonal que se prescribe en esquema de adición por pasos para el tratamiento del asma severa.
Objetivos: Informar la experiencia en pacientes con asma severa a quienes se aplicó omalizumab conforme a las guías internaciones, en un contexto de datos de mundo real.
Métodos: Estudio retrospectivo, clínico, observacional, abierto, analítico y transversal a partir de datos de la vida real. Se utilizó el esquema de Control del Asma de GINA 2006 para evaluar a los pacientes y con un cuestionario se calificaron las características del paciente, efectividad, seguridad y tolerancia al omalizumab.
Resultados: Se estudiaron 48 pacientes, 34 mujeres y 14 hombres, con edad promedio de 39 años. La duración promedio de la enfermedad fue de 26 años. La concentración sérica promedio de la IgE fue de 522 UI. Al inicio del tratamiento, todos los pacientes estaban sin control del asma; al final, en 69% se obtuvo control del asma, 19% estaba parcialmente controlado y 12% sin modificaciones. Los cambios se observaron en promedio a los siete meses.
Conclusión: El omalizumab es efectivo y seguro para tratar el asma severa cuando se aplica conforme las guías internacionales para el manejo del asma bronquial.
Palabras clave: Omalizumab; Asma; Manejo por pasos; Consulta diaria; Datos de mundo real
Abreviaturas y siglas
GINA, Global Initiative for Asthma
IgE, inmunoglobulina E
ISPOR, International Society for Pharmacoeconomics and Outcomes Research
ISSSTE, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado
LABA, long-acting beta agonists
PRD, patient reported outcomes
RWD, real world date
UI, unidad internacional/IU, international unit
Dos pioneros de la alergia, los doctores Karl Prutynitgz y Heins Kuster, en 1921 describieron el fenómeno de la trasferencia pasiva de la respuesta específica del alérgeno, y denominaron reagina a la sustancia presente en el suero del cuerpo que reaccionaba con este.1 Se requirieron 45 años más para poder identificar que esta sustancia pertenecía a una nueva clase de anticuerpos denominada inmunoglobulina E (IgE), la cual fue descubierta por el matrimonio Ishizaga en Estados Unidos de Norteamérica, y en forma más o menos paralela por los doctores Gunnar Johansson y Hans Bennich en el Instituto Karolimska, en Estocolmo, Suecia.1,2
Posteriormente se identificaron las características de este anticuerpo, así como el mecanismo de acción que esta glucoproteína tiene sobre la activación celular en mastocitos y basófilos, células determinantes en la alergia.3
El trabajo clásico de Burrows y colaboradores, donde muestran la prevalencia y asociación entre los valores de IgE y la reactividad a los alérgenos en las pruebas cutáneas, sirvió para demostrar su participación en la etiología alérgica del asma bronquial.4 A partir de estos descubrimientos se inició el desarrollo de diversas terapias dirigidas a órganos específicos, algunos mediadores de la inflamación y, actualmente, al anticuerpo IgE mediante terapias de anticuerpos monoclonales.5,6
El anticuerpo monoclonal omalizumab (Xolair®, Novartis Pharma Stein AG, Stein, Suiza), fue desarrollado por Tse Wen Chang y Nancy T. Chang, en Tanox (Houston, Texas)7 y aprobado por la Food and Drug Administration en 2003 y por la European Comission en 2009 para el tratamiento del asma persistente moderada y grave. En México fue autorizada su utilización como tratamiento en el 2007.8-12
Por su efectividad, diversos organismos internacionales como Estrategia Global para el Manejo y Prevención del Asma, GINA 2010;13 Estrategia Global para el Manejo y Prevención del Asma, GINA 2006;14 Guía del Manejo del Asma, Sociedad Británica de Tórax;15 Guía Española para el Manejo del Asma 2009;16 y Manejo del Asma Sociedad Canadiense de Tórax han incluido al omalizumab como terapia agregada en sus guías para el manejo del asma.17
El omalizumab ha sido documentado ampliamente en estudios de seguridad y eficacia, incluso para uso pediátrico.8 Debido a la farmacocinética del producto su efecto es retardado,3,18 lo cual inhibe la unión de la IgE libre con sus receptores específicos sin desplazar de las células blanco a los ya fijados, y disminuye la sensibilización o expresión de nuevos receptores.
De acuerdo con los estudios del INNOVATE, los efectos de omalizumab empiezan a presentarse entre la semana 12 y 16 de su administración, sin embargo, aún se desconoce la duración óptima de su terapia.19
Aunque el control del asma a menudo se logra en los ensayos clínicos, esto no es lo que se observa en la práctica clínica diaria.20 Algunos factores han sido identificados para explicar la escasa respuesta al tratamiento con omalizumab entre los que destacan la no adherencia al tratamiento y una técnica inhalatoria inadecuada que afecta el control del asma en la escena clínica diaria del médico tratante o en el mundo real.21
La Sociedad Internacional de Farmacoeconomía (ISPOR, International Society For Pharmacoeconomics and Outcomes Research), define los “datos del mundo real” (RWD, Real World Data) como aquellos datos usados por los decisores o planeadores en los sistemas sanitarios, que no son obtenidos de los ensayos clínicos convencionales, por lo tanto, son datos que se obtienen directamente en un contexto no experimental sobre medicamentos, pacientes y enfermedades.
Hay que hacer notar que las compañías farmacéuticas generan RWD con el propósito de cumplir normativas de farmacovigilancia posterior a la comercialización de sus productos, ya que el crecimiento de las exigencias regulativas ha aumentado la necesidad de los RWD, que además permiten detectar poblaciones de pacientes en los que el producto funciona mejor y si la prescripción es óptima (dosis en la que la compañía farmacéutica recomienda su producto); captar resultados directos del paciente y confirmar la eficacia y seguridad del medicamento en la realidad clínica (quehacer diario del médico); diferenciar el medicamento frente a otros (genéricos), ayudar a reducir las barreras de acceso al mercado, etcétera.
Las fuentes principales para la obtención de los RWD son los estudios observacionales, los retrospectivos, los reportes o datos de pacientes y sus resultados (Patient Reported Outcomes, PRD), las encuestas de salud dirigidas a la población general, los datos de pacientes recogidos por el profesional de salud, también ha coadyuvado a su obtención las gestiones realizadas por las companías farmacéuticas para cumplir con las normativas poscomercialización en farmacovigilancia.
Las diferencias entre el ensayo clínico aleatorizado y el estudio clínico de datos del mundo real se mencionan en el esquema propuesto por García López et al. (Cuadro 1).22-24
| Cuadro 1. Diferencias entre ensayos clinicos aleatorizados y datos del mundo real | ||
| Diseño | Estudios aleatorizados | RWD |
| Tipo de estudio | Experimental/intervencionista | Observacional/no intervencionista |
| Resultados | Eficacia, seguridad, calidad | Efectividad |
| Población | Restringida | Amplia sin restricciones |
| Monitorización | Intensa | No es necesaria |
| Aleatorización y ciego | Sí | No |
| Costes | Altos | Más barato |
| Referencias 22 a 24 | ||
Los estudios de vida real son un seguimiento discrecional del efecto general del tratamiento con el médico que trata a estos pacientes, sin probar hipótesis, las cuales ya fueron probadas en los estudios controlados y aleatorizados. Evalúan la efectividad y seguridad de dichos medicamentos en la clínica diaria, basándose en revisiones de los registros o expedientes clínicos de los pacientes que están bajo el tratamiento con el medicamento en cuestión.22,25-28
Cuando se confirma el diagnóstico de asma y se manejan sus comorbilidades, el asma grave se define como asma que requiere tratamiento con corticoides inhalados en dosis altas, más un segundo controlador, o corticosteroides sistémicos para prevenir que el asma se convierta en “no controlada” o que quede como “no controlada a pesar de esta terapia”. Se recomienda la terapia antiIgE con el anticuerpo omalizumab para este grupo de pacientes.29
Diversos estudios han documentado que la agregación de omalizumab en el esquema de pasos al tratamiento habitual del asma bronquial es efectiva y bien tolerada, disminuyendo significativamente las exacerbaciones del asma, los ingresos a urgencias y los requerimientos de glucocorticoides inhalados o sistémicos en pacientes con asma alérgica, de moderada-severa a severa no controlada.30-39
El propósito del presente estudio es reportar, en el escenario clínico cotidiano del médico especialista en un hospital del sector público, la experiencia del uso de omalizumab en pacientes con asma severa,29cuya severidad hizo que la aplicación del medicamento se considerara de utilidad dentro del tratamiento por pasos o al agregarlo como lo marcan las principales guías internaciones.13-17
A través de un estudio retrospectivo, con características de ensayo de WRD, observacional, abierto, clínico epidemiológico, analítico y transversal (un corte), se revisaron los expedientes clínicos de 78 pacientes derechohabientes del Hospital Regional Mérida, del ISSSTE, con diagnóstico de asma severa y que se encontraban bajo tratamiento con omalizumab. La edad de los enfermos oscilaba en rangos de los 7 a los 78 años. El análisis de la información se realizó de agosto de 2011 a octubre de 2014.
Los expedientes clínicos de los pacientes incluidos en el estudio fueron identificados a través de la lista de consumo del medicamento de la farmacia del hospital, que incluía a los enfermos y el consumo de 159 viales del fármaco al mes: un promedio 2 viales (300 mg) por paciente. A esta lista se agregaron tres pacientes que se encontraban bajo tratamiento con omalizumab en un servicio médico privado. Los pacientes tenían entre 1 y 3 años de tratamiento y acudían en forma regular a sus consultas en los servicios de alergia y neumología del hospital.
Para la recolección de la información se conformó un instrumento en el que se consideraron aspectos como:
Una vez registrada y revisada la información de los 78 expedientes, 30 fueron eliminados por no contar con datos que permitieran su análisis o que no cubrían los criterios de inclusión establecidos en el estudio. Por los tanto, en el estudio se incluyeron 48 expedientes correspondientes a igual número de pacientes y que contenían los datos requeridos.
En el análisis se realizaron dos determinaciones de los parámetros, una al principio (basal) en la que se consideró a todos los paciente en la escala de “no control de su asma” o asma severa de acuerdo a la clasificación de GINA y la definición propuesta por Chung, Wenzel, Brozek y colaboradores,13,28 antes de la administración del producto (inicio del tratamiento con omalizumab), y la siguiente determinación, al corte del estudio, cuando menos un año de tratamiento continuo con omalizumab e independientemente del tiempo de uso.
También se determinó el número de pacientes que se beneficiaron del tratamiento de acuerdo al esquema de clasificación de GINA: asma en control, asma parcialmente controlada, asma no controlada, el tiempo en que se obtuvo dicho beneficio, el nivel de IgE al comienzo del tratamiento, el número de pacientes que suspendieron el tratamiento, así como la evolución de los que suspendieron el tratamiento.
Todos los pacientes dieron su consentimiento, oral y por escrito, para la utilización de omalizumab como terapia regular de su padecimiento. Para el análisis de los datos se utilización porcentajes, media y desviación estándar.
La distribución según el sexo de los 48 pacientes estudiados: 34 de sexo femenino y 14, masculino. La edad media del total de la muestra estudiada fue de 39 años. De acuerdo a la información recabada, el tiempo de evolución de la enfermedad fue de 26 años en promedio. La concentración sérica de IgE en promedio fue de 522 unidades internacionales.
El manejo de la población de estudio se constituyó con dosis altas de glucocorticoide inhalado combinado con un agonista beta-2 de acción prolongada (LABA), más un modulador de leucotrienos (Montelukast). Este esquema de manejo se llevó a cabo en forma diaria y continuada durante al menos un año previo al tratamiento con omalizumab.
Una característica de estos pacientes es que todos presentaban exacerbaciones de asma severa, con dos a tres ingresos de dos o más días al servicio de urgencias, y cuando menos un ciclo de glucocorticoide sistémico de más de tres días en el año previo a la administración del medicamento. En cuanto al control, de acuerdo con la clasificación del asma de GINA 2006, en la medición basal todos los pacientes estaban en la clasificación de no controlados.
Al corte en octubre de 2014: 33 pacientes (69%), de acuerdo con la clasificación, estaban en control de su asma, de estos 21 mujeres y 12 hombres; nueve pacientes (19%) estaban parcialmente controlados; y seis (12%), no controlados, es decir, sin cambios en su evolución.
Estos cambios se observaron después de cuatro a cinco meses de tratamiento, en promedio a los siete meses de tratamiento. Ocho pacientes recibían o habían recibido inmunoterapia convencional, un paciente con IgE por arriba de 300 UI tuvo pruebas alérgicas cutáneas negativas (este paciente obtuvo control de sus síntomas con el tratamiento). Ningún paciente reportó efectos adversos, salvo alguna molestia en el momento y zona de la aplicación.
Después de más de cuatro meses, cinco pacientes suspendieron su tratamiento por diversas causas (falta de adherencia al tratamiento, sentirse bien desde las primeras aplicaciones, etcétera). Después de nueve meses no tenían reactivación de su asma, aunque continuaban con sus medicamentos a dosis plenas, estos no se tomaron en cuenta para el reporte (Figuras 1 a 3 y Cuadro 2).

Figura 1. Resultados del tratamiento con omalizumab.
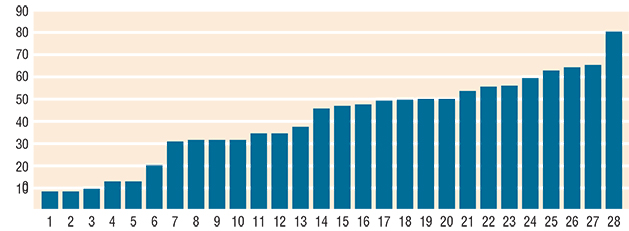
Figura 2. Edad de los 28 pacientes tratados con omalizumab. Edad promedio 39 años, rango de 7 a 78 años; 9 hombres y 14 mujeres; 8 con inmunoterapia convencional, 1 con pruebas cutáneas positivas.
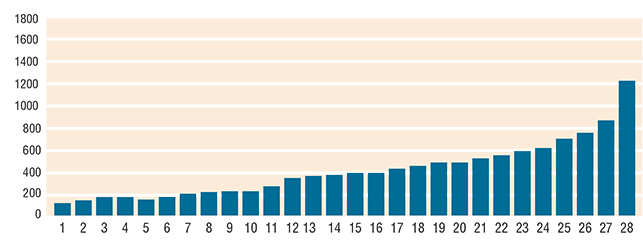
Figura 3. Valor de la IgE en 28 pacientes que lograron el control del asma. IgE promedio 522 UI. Tiempo promedio del asma 26 años.
| Cuadro 2. Resultados de tratamiento | ||||
| n | n | % | ||
| Excelente: asma en control | Varones | 12 | 33 | 69 |
| Mujeres | 21 | |||
| Bueno: asma parcialmente controlado | 9 | 19 | ||
| Sin cambios: asma no controlada | 6 | 12 | ||
| Total de pacientes | 48 | 100 | ||
Los pacientes tenían un tiempo de tratamiento promedio con omalizumab de 1.8 años, con una dosis media mensual de 2.5 viales (cada uno de 150 mg) lo que −de acuerdo con las recomendaciones del productor del laboratorio, que debe de servir de guía para la dosificación− indica según los valores de la IgE reportados que algunos podrían estar subdosificados, situación que se menciona en todos los trabajos de datos de vida o mundo real, en donde el clínico tratante subdosifica el omalizumab a pesar de las indicaciones.
Se obtuvo un tiempo de respuesta del medicamento de siete meses, sin embargo, es de hacer notar que la mejoría se observaba desde los 4 a 5 meses de tratamiento, de acuerdo a lo reportado en los expedientes, lo cual coincide con lo descrito en la literatura.
Con base en los resultados de nuestro estudio, el tratamiento del asma severa con omalizumab es efectivo y seguro cuando se aplica agregado a la terapia de pasos indicada por las diversas guías que existen.
En este trabajo de investigación, se obtuvo un beneficio en el 80% de los pacientes en quienes se agregó omalizumab al esquema por pasos. Nuestros resultados coinciden con otros estudios de vida real efectuados a nivel internacional: 80% en el estudio Persist;37 50% en el estudio conjunto franco-alemán;33 77% en un estudio italiano,36 valor que prácticamente coincide con nuestro reporte; 87% del estudio del Reino Unido;34 y 69% del estudio eXpeRience.33 Todos estos en el entorno de los WRD o escenario de trabajo diario del médico.
Aunque no se conoce qué pasa con el control del asma al suspender el omalizumab en los pacientes que lograron el control del asma, los cinco pacientes que lo suspendieron, a los nueve meses se mantenían en control. M. Molimard y colaboradores reportaron una media de 13 meses para la reactivación de la pérdida del control del asma,40 Noop A., Johansson S.G.O., y Adedoyin J. en otra publicación mencionan a un grupo de pacientes que a seis años de haber suspendido el tratamiento con omalizumab que se aplicaron por tres años, aún presentaban asma pero de tipo leve y estable,41-44 por lo que la decisión de suspender el omalizumab después de una terapia exitosa larga debe considerarse después de sopesar los beneficios y riesgos,32 sobre todo en pacientes con una historia de asma severa o moderada severa persistente de largo tiempo, que han requerido previamente altas dosis de glucocorticoides inhalados o sistémicos; y en quienes, de acuerdo con la historia natural del proceso, pueden evolucionar a un asma casi fatal.45
Con el advenimiento de la nueva era de los biológicos para el tratamiento de enfermedades con compromiso inmunológico, muchos han demostrado su eficacia y seguridad en el manejo de estos pacientes. El tratamiento del asma de difícil control, el asma severa o el asma no controlada, con omalizumab no es la excepción.
Llama la atención que aunque los efectos adversos están reportados, en nuestro grupo no se observaron. Sin embargo, en grupos pequeños como el de López Tiro, similar al nuestro, efectuado en el Hospital López Mateos del ISSSTE, se observó que durante los tres años que duró su estudio se reportaron cuatro eventos adversos: un caso de dolor osteoarticular, dos casos de cefalea leve y un caso de síncope vaso-vagal. Asimismo, cinco pacientes abandonaron el estudio por tuberculosis pulmonar, anafilaxia leve, cefalea intensa, desapego al tratamiento, pérdida de peso.
Se debe continuar con la caracterización adecuada del paciente que puede beneficiarse del tratamiento con omalizumab, más ahora que sabemos que existen los fenotipos del asma y que estos son importantes en el momento de decidir la terapéutica que se le va a aplicar al paciente.42
De acuerdo con las condiciones basales de actividad al inicio del tratamiento y al corte del estudio, y en consideración de la clasificación GINA 2006 de controlado, controlado parcialmente y no controlado podemos concluir que:
Los autores declaran que: no se realizó ningún procedimiento de experimentación, ya que la investigación fue un ensayo de poscomercialización y todos los pacientes estaban en tratamiento regular de su padecimiento; siguieron los protocolos de su centro de trabajo en la publicación de los datos de los pacientes para conservar el anonimato de los mismos; y los pacientes incluidos en el estudio recibieron información suficiente y concedieron su consentimiento en forma voluntaria.
Los autores no tienen ningún conflicto de intereses que declarar. Los investigadores no recibieron ninguna financiación específica para el desarrollo del estudio.
Recibido: 2015-10-13
Aceptado: 2016-05-11
Correspondencia: Jorge Bernardo Vargas-Correa. jbvcmer@prodigy.net.mx
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons