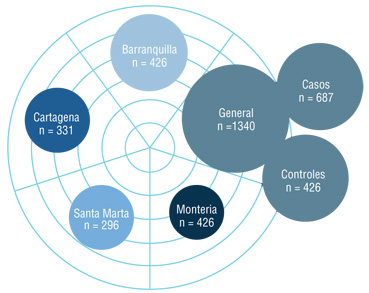
Figura 1. Descripción de la población estudiada. Se analizaron 1340 escolares procedentes de asentamientos marginados de cuatro ciudades ubicadas en la costa caribe colombiana.
ARTÍCULO ORIGINAL
Eduardo Egea,1 Gloria Garavito,1 Luis Fang,2 Dary Luz Mendoza,3 José Miguel Escamilla,4 Elsie De Los Ríos,5 Rodolfo Dennis,6 Mario Sánchez-Borges7
1Universidad del Norte, División Ciencias de la Salud, Grupo de Investigación en Inmunología y Biología Molecular. Barranquilla, Colombia.
2Corporación Universitaria Rafael Núñez, Programa de Odontología. Cartagena, Colombia.
3Universidad del Atlántico, Facultad de Ciencias Básicas, Laboratorio de Bioquímica de Macromoléculas. Barranquilla, Colombia.
4Universidad de Cartagena, Facultad de Medicina. Cartagena, Colombia.
5Clínica Saima, Unidad de Alergología. Montería, Colombia.
6Fundación Cardioinfantil, Bogotá, Colombia.
7Centro Medico Docente La Trinidad, Departamento de Alergia e Inmunología Clínica. Caracas, Venezuela
How to cite this article: Egea E, Garavito G, Fang L, Mendoza DL, Escamilla JM, De Los Ríos E, Dennis R, Sánchez-Borges M. [Influence of serum levels of vitamin D on IgE response in schoolchildren with asthma in poor communities]. Rev Alerg Mex. 2016 Jul-Sep;63(3):252-269.
Background: Asthma is a common disease in the world and vitamin D (Vit-D) has been associated with the presence and severity of this disease.
Objective: To establish the association between levels of Vit-D and IgE response in schoolchildren with asthma living in four cities in Colombia.
Methods: Case-control study in 1340 schoolchildren (687 asthmatic and 653 controls) from communities in extreme poverty in Barranquilla, Cartagena, Santa Marta, and Montería. Serum concentrations of Vit-D, total IgE, and anti-Dermatophagoides farinae, Periplaneta americana, and Ascaris lumbricoides (AL) specific IgE were measured.
Results: Controls reported higher concentrations of Vit-D [61.9 ± 28.4 ng/mL] than cases [53 ± 23.3 ng / mL] (p < 0.05). Total IgE was higher in cases (p < 0.05). Only anti-AL IgE showed a clear difference: in controls, optical density was 0.27 ± 0.25; in cases, 0.22 ± 0.24 (p < 0.05). Vit-D showed differences between cases and controls in each population.
Conclusions: An association could not be demonstrated between Vit-D deficiency and asthma, as total IgE was elevated in patients and controls. The results suggest that Vit-D influences the specif IgE response in poor asthmatic children in areas endemic for helminthiasis.
Keywords: Vitamin D; Allergens; IgE; Pediatric asthma; School; Ascaris lumbricoides
Este artículo debe citarse como: Egea E, Garavito G, Fang L, Mendoza DL, Escamilla JM, De Los Ríos E, Dennis R, Sánchez-Borges M. Influencia de los niveles séricos de vitamina D sobre la respuesta IgE en niños escolares con asma en comunidades pobres. Rev Alerg Mex. 2016;63(3):252-269.
Antecedentes: El asma es una enfermedad frecuente en el mundo y la vitamina D (Vit-D) se ha asociado con la presencia y severidad de esta enfermedad.
Objetivo: Establecer la asociación entre los niveles de Vit-D y la respuesta IgE en escolares con asma residentes de cuatro ciudades colombiananas.
Métodos: Estudio de casos y controles en 1340 escolares (687 asmáticos y 653 controles) de comunidades en extrema pobreza de Barranquilla, Cartagena, Santa Marta y Montería. Se midieron las concentraciones séricas de Vit-D, IgE total e IgE específica anti Dermatofagoides farinae, Periplaneta americana y Ascaris lumbricoides (AL).
Resultados: Los controles reportaron concentraciones mayores de Vit-D [61.9 ± 28.4 ng/mL] que los casos [53 ± 23.3 ng/mL] (p<0.05). La IgE total fue mayor en los casos (p<0.05). Solo IgE anti-AL mostró una diferencia clara: controles, densidad óptica 0.27 ± 0.25; casos 0.22 ± 0.24 (p<0.05). La Vit-D presentó diferencias entre casos y controles en cada población.
Conclusiones: No se pudo demostrar la asociación entre deficiencia de Vit-D y asma, dado que la IgE total estuvo elevada en los pacientes y en los controles. Los resultados sugieren que la Vit-D influye en la respuesta IgE específica en niños asmáticos pobres en zonas endémicas para helmintiasis.
Palabras clave: Vitamina D; IgE alérgenos; Asma pediátrica; Niño; Ascaris lumbricoides
Abreviaturas y siglas
25[OH] D3, 25-hidroxivitamina D3
AL, Ascaris lumbricoides
DE, desviación estándar
DO, densidad óptica
IgE, inmunoglobulina E
IOM, Institute of Medicine
ISAAC, The International Study of Asthma and Allergies in Childhood
MgCl2, cloruro de magnesio
NaN3, azida de sodio
UV, ultraviolet
Vit-D, vitamina D
Las enfermedades alérgicas se han convertido en un problema de salud pública a nivel mundial. En Colombia, país ubicado en el cinturón del trópico, la prevalencia de estas enfermedades ha aumentado de manera relevante con un comportamiento epidemiológico acorde a lo descrito en la literatura.1,2
El asma bronquial es una de las enfermedades crónicas más frecuentes a nivel mundial y afecta a 300 millones de personas aproximadamente.3 Los mecanismos que conducen a su eventual desarrollo con diferentes expresiones clínicas son complejos e interactivos.4 La exposición a infecciones como la helmintiasis durante los primeros años de vida ha emergido como factor importante que modifica el riesgo de desarrollar asma en una persona genéticamente susceptible.5,6
La relación entre la infección por helmintos, en especial Ascaris lumbricoides (AL), y atopia y asma, es motivo de controversia. La helmintiasis ha sido asociada con la reducción del riesgo para atopia y/o el desencadenamiento de los síntomas de asma en áreas con alta prevalencia de infecciones parasíticas, pero con riesgo incrementado para el desarrollo de atopia y asma en áreas con baja prevalencia de estas parasitosis.7
Por otra parte, los niveles séricos de vitamina D (Vit-D) se han asociado con la severidad del asma a través de su agonista más importante 1,25, Dihidroxivitamina D3, que inmunnomodula y regula la activación, proliferación, diferenciación y producción de citocinas en diferentes subpoblaciones de células inmunocompetentes CD4+ Th2.8 Se ha demostrado que la administración de Vit-D en el modelo murino protege de un proceso inflamatorio con infiltración eosinofílica pulmonar, altera los perfiles de citocinas, los niveles de IgE y los patrones de eosinofilia en las vías aéreas. Esto último se observa en la etapa de sensibilización por alérgenos, lo que sugiere que esta hormona puede tener influencia en el desarrollo de las enfermedades alérgicas y en especial en el asma bronquial.9
Poco o nada se conoce acerca de la influencia de los niveles séricos de la vitamina D, con la severidad del asma en poblaciones vulnerables y marginadas socioeconómicamente en el litoral Caribe, en especial en la costa colombiana. Existen estudios que evidencian la respuesta IgE específica anti-AL en grupos mulatos de Cartagena.10-12 Sin embargo, no se cuenta con datos acerca de cómo los niveles séricos de vitamina D y la respuesta IgE anti-AL influyen en el asma alérgica pediátrica en el Caribe colombiano. El propósito de este estudio fue establecer la asociación entre los niveles de 25-hidroxivitamina D3 (25(OH) D3) y la respuesta IgE Total e IgE alérgeno específica anti-Blomia tropicalis, anti-Dermatofagoides farinae, anti-Periplaneta americana y anti-Ascaris lumbricoides con el asma alérgica, en escolares residentes en asentamientos de comunidades pobres y marginadas, ubicadas en cuatro ciudades del Caribe colombiano.
Este es un estudio con un diseño de casos y controles, que involucró 1340 escolares; entre ellos 687 asmáticos y 653 controles sanos, procedentes de asentamientos marginados de las cuatro principales ciudades de la Costa Caribe colombiana: Barranquilla, Cartagena, Santa Marta y Montería (Figura 1).

Figura 1. Descripción de la población estudiada. Se analizaron 1340 escolares procedentes de asentamientos marginados de cuatro ciudades ubicadas en la costa caribe colombiana.
Características de la población de estudio
El diseño de este proyecto, el método y los criterios de selección de los participantes, se han descrito en trabajos previos.1,2 En Colombia, la población se encuentra estratificada socioeconómicamente entre los estratos 1 a 6, acorde a sus niveles de pobreza. La mayoría de la población en áreas citadinas pertenecen a los estratos 1, 2 y 3. Los niños asentados en estos se caracterizan por vivir en hacinamiento (tres o más personas por dormitorio); con ausencia o limitación del acceso a los servicios públicos: agua, electricidad y saneamiento ambiental; así como bajo nivel y alta deserción escolar.13 Todos los participantes incluidos en el presente estudio pertenecían a los estratos 1 a 3.
Fenotipos clínicos de los escolares asmáticos
Los escolares y/o sus padres participantes en este estudio se tamizaron mediante un cuestionario adaptado y modificado del estudio ISAAC.14 En este cuestionario el sujeto-caso se definió como aquel niño que confirmó síntomas y signos de asma en los últimos 12 meses antes de su ingreso al estudio, historia de crisis asmática diagnosticada por un médico y antecedentes de asma y/o rinitis del niño y/o sus padres. Todos los sujetos que cumplieron con estos criterios fueron evaluados clínicamente por un médico del equipo de investigadores para confirmar el diagnóstico de asma.
Los controles se definieron como aquellos individuos clínicamente normales sin antecedentes de asma, rinitis y/o cualquier otra enfermedad alérgica en ellos o sus padres; sin reporte de diagnóstico clínico de asma, rinitis alérgica y dermatitis atópica. Todos los sujetos del estudio habitaban en zonas deprimidas, bajo condiciones socioeconómicas similares y y evidenciaron los índices gubernamentales más precarios de pobreza en Colombia, en cada una de las cuatro ciudades involucradas.13
Muestras biológicas
Con previo asentimiento y consentimiento informado, a todos los sujetos se les tomaron muestras de sangre periférica para la obtención de suero y plasma. Se tomaron un total de 10 ml de sangre en tubos Vacutainer (Beckton Dickinson & Company, Franklin Lakes, Estados Unidos) para la cuantificación de vitamina D y los títulos de IgE total y alérgeno específica. Todas y cada una de las muestras se tomaron en ayunas y antes de las 7 a.m. Ninguno de los pacientes había recibido vitamina D durante los últimos 6 meses previos a su ingreso al estudio. Inmediatamente después de la recolección, las muestras fueron envueltas en papel de aluminio (para evitar el acceso de la luz UV) y se almacenaron a -20 °C hasta su posterior análisis.
Consideraciones éticas
El presente estudio contó con la aprobación del Comité de Ética de la División de Ciencias de la salud de la Universidad del Norte en Barranquilla, Colombia. Todos los consentimientos y asentimientos se guardaron y permanecen bajo custodia en los archivos del proyecto.
Niveles séricos de vitamina D
Los niveles séricos de 25-hidroxivitamina D se midieron mediante la técnica de inmunoensayo enzimático (Immunodiagnosis Systems Boldon, Tyne and Wear, UK). Las concentraciones fueron clasificadas según el punto de corte establecidos por el Institute of Medicine (IOM), donde <10 ng/ml de 25(OH)D corresponde a niveles deficientes; 10 a < 30 ng/mL como vitamina D, insuficiente; ≥30 a <100 ng/ml como vitamina D, suficiente; y ≥100 ng/ml como posible intoxicación de vitamina D.15
Niveles séricos de IgE Total e IgE específicas
A todos los participantes se les estudiaron los niveles de IgE total y anticuerpos IgE específicos de Ascaris lumbricoides. A los integrantes de un subgrupo de 323 casos (47 %) y 280 (42.8 %) controles seleccionados aleatoriamente se les midieron los títulos de anticuerpos IgE específicos de Blomia tropicalis y Dermatofagoides farinae. Mientras que la cuantificación de IgE anti-Periplaneta americana se realizó en un subgrupo de 306 (44.5 %) casos y 279 controles (42.7 %) también seleccionados aleatoriamente.
Los niveles séricos de IgE total se cuantificaron mediante un kit comercial (Monobind Inc.) y la técnica de inmunoensayo enzimático (Phadia UniCAP System, Pharmacia Upjohn, Uppsala, Sweden). Estos datos se clasificaron en niveles normales y elevados a partir de las concentraciones de referencia según la edad del individuo, así: de 0-3 años (<10 UI/ml); de 3-4 años (<25 UI/ml); de 4-7 años (<50 UI/ml); y de 7-14 años (<100 UI/ml).
La detección de IgE anti-Dermatophagoides pteronyssinus, IgE anti-Blomia tropicalis e IgE anti-Periplaneta americana se realizó mediante la tecnología ImmunoCAP (Phadia UniCAP System, Pharmacia Upjohn, Uppsala, Sweden). Esta cuantificación se realizó en subgrupos representativos de casos y controles, los cuales fueron escogidos aleatoriamente. Las concentraciones de IgE específica, se clasificaron según los criterios de Phadia ImmunoCAP, donde los valores se expresan en kUA/l. Valores >0.35 kUA/l representan un aumento progresivo en la concentración relativa de anticuerpos específicos al alérgeno. Los valores <0.35 kUA/l representan niveles ausentes o no detectables de anticuerpos. La categorización de los anticuerpos específicos se clasificó como sigue: 0 - < 0.35 kUA/l ausente o no detectable; 0.35 - < 0.70 kUA/l bajo; 0.70 - < 3.50 kUA/l moderado; 3.50 - < 17.5 kUA/l alto; 17.5 - < 50.0 kUA/l muy alto I; 50.0 - < 100 kUA/l muy alto II; 100 kUA/l muy alto III.
Determinación de anticuerpos IgE anti-Ascaris lumbricoides
La prueba se realizó mediante un ensayo de ELISA indirecto casero, y se usó como antígeno un extracto de cuerpo entero de AL previamente producido por el grupo de investigación.16 En breve, el extracto de AL se disolvió en tampón carbonato/bicarbonato de sodio 0.2 M (pH 9.2), hasta una concentración final de proteínas de 50 μg/ml. En una placa de microtitulación de 96 pozos (Nunc-Immuno™MicroWell™ de Thermo Scientific®) se adsorbieron 5 μg de proteína por pozo, correspondiente a 100 μl del extracto diluido. La adsorción se llevó a cabo durante 16 horas a temperatura ambiente; los pozos se bloquearon durante 3 horas con solución de bloqueo (PBS1X, BSA 0.02%, NaN3 0.02%). Los pozos se incubaron por 16 h con 100 μL de una dilución 1/5 de los sueros de los sujetos involucrados en el estudio.
Enseguida se adicionó a cada pozo 100 μl de un segundo anticuerpo, anti-IgE conjugada a la enzima fosfatasa alcalina (Sigma®); IgG de origen caprino diluido 1/2000 encubándose la placa en cámara húmeda por 2 horas. Posteriormente se adicionó a cada pozo 100 μl del sustrato para la enzima fosfatasa alcalina, el p-nitrofenil fosfato disuelto en solución de dietanolamina al 10% v/v, MgCl2 0.5 mM (1 mg/ml). La reacción se leyó con una longitud de 405 nm, mediante el uso del Software Gen5™ Data Analysis (BioTek® Instruments, Inc). Para la discriminación diagnóstica de esta prueba se estableció un punto de corte, el cual se calculó sumando el doble de la desviación estándar al promedio de los valores de absorbancia de las muestras negativas. Para este estudio, el punto de corte fue una densidad óptica (DO) de 0.26 con una desviación estándar de 0.076
Análisis estadístico
La asociación entre niveles séricos de vitamina D, IgE total e IgE alérgeno-específicas con asma se estimó a partir de la diferencia entre los niveles y títulos entre niños asmáticos y controles en los cuatro grupos poblacionales mediante la prueba de U de Mann-Whitney (comparación entre dos grupos) y Kruskal-Wallis (comparación entre 3 o más grupos). Por su parte, la distribución de estas variables no mostró normalidad según la prueba de Shapiro-Wilk, por lo tanto se analizaron como variables no paramétricas. Se analizó la asociación de estas variables (categorizadas) con la enfermedad. Mediante tablas de contingencia y mediante la aplicación de pruebas de χ,2 con corrección por continuidad de Yate o prueba exacta de Fisher, según las circunstancias.
Se estimó el grado de asociación entre la vitamina D, IgE total e IgE alérgeno-específicas mediante la estimación del coeficiente de correlación de Spearman. También se diseñaron modelos de regresión lineal multivariada con el método de pasos sucesivos, en los que las variables de estudio (vitamina D e IgE alérgeno-específicas) dan respuesta a los niveles de IgE total.
Todos los análisis estadísticos fueron realizados mediante el software estadístico SPSS v20 (IBM® SPSS® Statistics 20; IBM Corp., USA). La significancia estadística fue interpretada como p<0.05.
La muestra analizada estuvo constituida por 1340 escolares que reportaron un promedio de edad de 8.72 años (DE: 2.39). El 54.8 % (n=374) son del género masculino y el 45.2 % (n=309) restante corresponde al género femenino. La descripción sociodemográfica según las cuatro ciudades se muestra en el Cuadro 1.
| Cuadro 1. Características sociodemográficas de los grupos de estudio | ||||||||||
| General | Barranquilla | Cartagena | Santa Marta | Montería | ||||||
| n=1340 | % | n=426 | % | n=331 | % | n=296 | % | n=287 | % | |
| Grupo | ||||||||||
| Casos | 687 | 51.3 | 213 | 50 | 164 | 49.5 | 151 | 51 | 159 | 55.4 |
| Controles | 653 | 48.7 | 213 | 50 | 167 | 50.5 | 145 | 49 | 128 | 44.6 |
| Sexo | ||||||||||
| Masculino | 374 | 54.8 | 235 | 55.3 | 138 | 41.7 | 147 | 50.3 | 149 | 51.9 |
| Femenino | 309 | 45.2 | 190 | 44.7 | 193 | 58.3 | 145 | 49.7 | 138 | 48.1 |
| Edad [media ± DE] | 8.72 ± 2.39 | 8.89 ± 2.33 | 8.95 ± 2.27 | 8.06 ± 1.97 | 8.9 ± 2.84 | |||||
| DE: Desviación estándar. | ||||||||||
Concentraciones séricas de vitamina D, IgE total e IgE alérgeno-específicas
En la muestra estudiada se observó que los controles reportaron concentraciones significativamente superiores de vitamina D (61.9 ± 28.4 ng/ml) en relación con los niños con asma alérgico (53 ± 23.3 ng/ml) (p<0.05). Sin embargo, estos promedios corresponden a concentraciones de vitamina D dentro de los niveles suficientes. Por otra parte, la IgE total se mostró significativamente elevada en los casos (392.1 ± 306.8 UI/ml) a diferencia de los controles (335.8 ± 273.1 UI/ml) (p<0.05). En cuanto a la respuesta IgE alérgeno-específica, solo los anticuerpos IgE anti-Ascaris lumbricoides mostraron una diferencia clara, el grupo control reportó una absorbancia promedio de 0.27 ± 0.25 en comparación a los casos cuya absorbancia fue significativamente menor con una densidad óptica de 0.22 ± 0.24 (p<0.05) (Cuadro 2).
| Cuadro 2. Concentraciones séricas de vitamina D, IgE total e IgE alérgeno-específicas | |||
| Casos Media ± DE | Controles Media ± DE | p* | |
| Vitamina D (ng/mL) | 53 ± 23.3 | 61.93 ± 28.4 | 0.00** |
| IgE total (UI/ml) | 392.1 ± 306.8 | 335.81 ± 273.1 | 0.00** |
| IgE A. lumbricoides (Abs) | 0.22 ± 0.24 | 0.27 ± 0.25 | 0.00** |
| IgE D. farianae (KUA/l) | 8.37 ± 21.7 | 3.63 13.0 | 0.23 |
| IgE B. tropicalis (KUA/l) | 5.6 ± 17.4 | 3.49 ± 12.5 | 0.87 |
| IgE P. americana (KUA/L) | 1.07 ± 5.0 | 0.63 ± 1.62 | 0.16 |
| DE: Desviación estándar, *U de Mann Whitney test. **p<0.05 | |||
El análisis según ciudades demostró que los casos procedentes de Barranquilla mostraron niveles significativamente elevados de IgE total (391.5 UI/mL) e IgE anti-D. farinae (14.8 kUA/l), mientras que los controles reportaron concentraciones significativamente elevadas de vitamina D (71.05 ng/mL) e IgE anti-A. lumbricoides (0.26 OD). Por su parte, los casos de Cartagena demostraron niveles superiores de vitamina D (56.2 ng/mL), mientras que los controles reportaron concentraciones elevadas de IgE total (413.4 UI/ml) e IgE anti-A. lumbricoides (0.32 OD). En Santa Marta se asocian los casos con concentraciones significativamente mayores de IgE anti-A. lumbricoides (0.27 OD) y los controles con vitamina D (69.7 ng/ml). En Montería sólo los controles se asociaron con niveles elevados de IgE total (383.4 UI/ml) (Figura 2).

Figura 2. Concentraciones séricas de vitamina D, IgE total e IgE antígeno específicas en los grupos de estudio. A) en todos los grupos de estudio el promedio de vitamina D sérica se encuentra dentro de los niveles suficientes. Sin embargo se observan concentraciones significativamente elevadas en los casos de Cartagena y controles del resto de las ciudades. B) se observa que los asmáticos de Barranquilla y controles de Cartagena y Montería mostraron IgE total significativamente elevada. C) solo los asmáticos de Barranquilla mostraron IgE anti-D. farinae significativamente elevada. D) y E) no se observó diferencia estadísticamente significativa en la respuesta IgE anti-P. tropicalis e IgE anti-P. americana entre casos y controles de los cuatros grupos de estudio. F) se observan valores significativamente elevados de IgE anti-A. lumbricoides en casos de Santa Marta y controles de Barranquilla y Cartagena. Líneas de color azul representan los controles. Líneas de color verde corresponden a los controles. * valores de p<0.05.
Al transformar los datos de vitamina D, IgE total e IgE alérgeno específica según los valores de referencia antes descritos, se pudo identificar que el 83.4% (n=573) de los niños asmáticos y el 74.7% (n=487) de los controles presentaron niveles suficientes de vitamina D; a su vez un 14.2% (n=98) de los casos mostraron niveles deficientes o insuficientes de esta vitamina en comparación con los controles que fueron el 13.5% (n=88) (p<0.05). Por otra parte, el 85.3% (n=585) de los casos presentaron IgE Total elevada a diferencia de los controles (77.3%; n=505) (p<0.05). Con respecto de la respuesta IgE alérgeno-específica, solo la respuesta IgE anti-D. farinae mostró una diferencia significativa entre casos y controles, el 53.9% (n=174) de los casos se encuentra sensibilizado a este ácaro a diferencia del 48.6% (n=136) de los controles (p<0.05).
Según la ciudad de procedencia se observó que en Barranquilla el 8.9% (n=19) de los casos mostraron deficiencia e insuficiencia de vitamina D a diferencia de los controles (1.9%; n=4) (p<0.05). En Cartagena el 9.7% (n=16) de los niños enfermos presentaron deficiencia e insuficiencia a diferencia de los controles cuyo número es significativamente superior (26.3%; n=44) (p<0.05). En Santa Marta, el porcentaje de casos con deficiencia e insuficiencia de vitamina D es del 29.8% (n=45) a diferencia de los controles (9%; n=13) (p<0.05). En Montería el 11.3% (n=18) de los casos mostraron insuficiencia de vitamina D en comparación al 21.3% (n=27) de los controles (Cuadro 3).
| Cuadro 3. Concentraciones de la vitamina D en los grupos de estudio | |||||||||||||||||||||
| Barranquilla | Cartagena | Santa Marta | Montería | ||||||||||||||||||
| Vitamina D | Caso | Control | p* | Caso | Control | p* | Caso | Control | p* | Caso | Control | p* | |||||||||
| n=213 | % | n=213 | % | n=164 | % | n=167 | % | n=151 | % | n=145 | % | n=159 | % | n=128 | % | ||||||
| Deficiente | 4 | 1.9 | 1 | 0.5 | 0.015¤ | 1 | 0.6 | 2 | 1.2 | 0.00¤ | 11 | 7.3 | 3 | 2.1 | 0.00¤ | --- | --- | 1 | 0.8 | 0.00¤ | |
| Insuficiente | 15 | 7 | 3 | 1.4 | 15 | 9.1 | 42 | 25.1 | 34 | 22.5 | 10 | 6.9 | 18 | 11.3 | 26 | 20.5 | |||||
| Suficiente | 184 | 86.4 | 197 | 92.5 | 142 | 86.6 | 123 | 73.7 | 106 | 70.2 | 108 | 74.5 | 141 | 88.7 | 59 | 46.5 | |||||
| Intoxicación | 10 | 4.7 | 12 | 5.6 | 6 | 3.7 | --- | --- | --- | --- | 24 | 16.6 | --- | --- | 41 | 32.3 | |||||
| *Prueba de Chi-cuadrado. ¤p<0.05 | |||||||||||||||||||||
En cuanto a la respuesta IgE total y sensibilización IgE alérgeno específica, en Barranquilla se observó una diferencia significativa en la respuesta de IgE total, el 83.1% (n=177) de los casos presentan niveles elevados de anticuerpos IgE total, a diferencia del 61.5% (n=131) de los controles (p<0.05). En cuanto a la respuesta IgE específica anti-Ascaris lumbricoides, el 17.4 % (n=37) de los casos se encuentran sensibilizados (p<0.05), mientras que en Santa Marta la frecuencia de los casos sensibilizados es del 39.1% (n=59) (p<0.05). En cuanto a la respuesta IgE específica a ácaros del polvo casero, los casos de Barranquilla presentan un 74.7 % (n=71) de sensibilización IgE anti-D. farinae y un 65.3 % de sensibilización IgE anti-B. tropicalis (p<0.05). La sensibilización a P. americana no mostró diferencia significativa entre casos y controles en cada ciudad (Figura 3).

Figura 3. Respuesta IgE total y sensibilización a alérgenos. Se destaca la respuesta IgE total y sensibilización IgE anti-A. lumbricoides, D. farinae y B. tropicalis en los individuos de Barranquilla. *valores de p<0.05 contraste entre casos y controles.
Comportamiento de la respuesta IgE y niveles de vitamina D entre las poblaciones del estudio
Al comparar el comportamiento y distribución de los datos correspondientes a los niveles de vitamina D, IgE total e IgE alérgeno-específicas, la respuesta IgE total mostró los valores mas elevados en los casos de Barranquilla (392 UI/ml), seguida por Cartagena (369 UI/ml), Santa Marta (322 UI/ml) y Montería (262 UI/ml) (p<0.05). En los controles se observó mayor variabilidad, en Cartagena se reportaron concentraciones de 413 UI/ml, seguida por Montería, Santa Marta y Barranquilla (p<0.05) (Figura 4).

Figura 4. Distribución de la IgE total en los cuatro grupos de estudio. Las concentraciones de IgE total se mostraron elevadas tanto en casos como en controles, en los cuatro grupos de estudio. Se destaca el comportamiento variable en la respuesta IgE total en los controles.
Por otra parte, también se observó comportamiento variable en los niveles de vitamina D e IgE antígeno-específicos tanto en casos como controles. Mientras que en los casos la vitamina D reporta un comportamiento descendiente desde Barranquilla hasta Montería. Los controles de Barranquilla y Santa Marta mostraron concentraciones superiores a las de Cartagena y Montería. La respuesta IgE alérgeno específica mostró variabilidad significativa entre las cuatro ciudades (Figura 5).
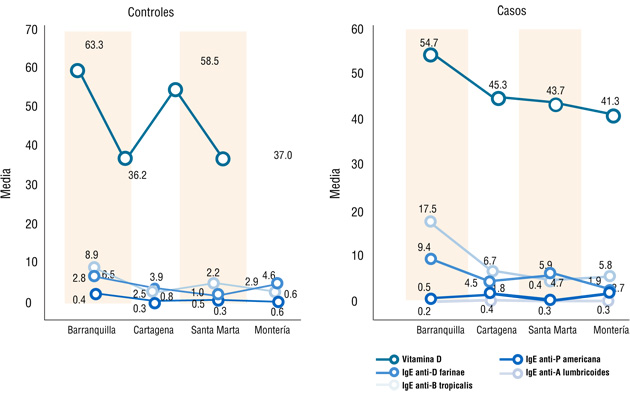
Figura 5. Distribución de la vitamina D e IgE antígeno específica en los cuatro grupos de estudio.
Análisis de la respuesta IgE total en escolares asmáticos pobres del Caribe
Al evaluar el grado de asociación entre los títulos de IgE total, los niveles séricos de vitamina D y la respuesta IgE específica se demostró que la respuesta IgE total se correlaciona con los anticuerpos IgE anti-A. lumbricoides (Rho:0.154), anti-D. farinae (Rho:0.305) y anti-B. tropicalis (Rho:0.261) en los casos de Barranquilla. En Cartagena los casos IgE total se correlacionan negativamente con IgE anti-A. lumbricoides (Rho: -0.317) e IgE anti-B. tropicalis (Rho:-0,227). En Santa Marta IgE total de los casos se correlaciona positivamente con los cuatro alérgenos evaluados. Mientras que en Montería la IgE total de los casos solo se correlaciona con la IgE anti-A. lumbricoides (Rho:0.348) (Cuadro 4).
| Cuadro 4. Correlación de la vitamina D y la respuesta IgE total y alérgeno-específica | |||||||
| Casos | |||||||
| Controles | Vitamina D | IgE Total | IgE A. lumb | IgE D. farinae | IgE B. tropicalis | IgE P. americana | |
| Barranquilla | |||||||
| Vitamina D | -0.218* | -0.182* | -0.196 | -0.148 | -0.057 | ||
| IgE Total | -0.014 | 0.154* | 0.305* | 0.261* | 0.136 | ||
| IgE A. Lumb | -0.121 | -0.094 | 0.318* | 0.287* | 0.172 | ||
| IgE D. Farinae | -0.138 | 0.364* | 0.371* | 0.726* | 0.573* | ||
| IgE B. Tropicalis | -0.064 | 0.427* | 0.389* | 0.851* | 0.568* | ||
| IgE P. Americana | -0.018 | 0.368* | 0.349* | 0.674* | 0.672* | ||
| Cartagena | |||||||
| Controles | Vitamina D | 0.146 | -0.414* | -0.086 | -0.042 | 0.052 | |
| IgE Total | -0.066 | -0.317* | -0.199 | -0.227* | -0.222 | ||
| IgE A. Lumb | -0.073 | 0.19 | 0.316* | 0.383* | 0.331* | ||
| IgE D. Farinae | 0.11 | 0.231* | 0.103 | 0.915* | 0.752* | ||
| IgE B. Tropicalis | 0.135 | 0.183 | 0.148 | 0.911* | 0.723* | ||
| IgE P. Americana | 0.025 | 0.062 | 0.066 | 0,639* | 0.648* | ||
| Santa Marta | |||||||
| Controles | Vitamina D | -0.049 | 0.16* | 0.082 | 0.053 | 0.03 | |
| IgE Total | -0.136 | 0.279* | 0.283* | 0.328* | 0.253* | ||
| IgE A. Lumb | -0.481* | 0.161 | 0.526* | 0.535* | 0.548* | ||
| IgE D. Farinae | -0.157 | 0.51* | 0.354* | 0.959* | 0.737* | ||
| IgE B. Tropicalis | -0.05 | 0.51* | 0.303* | 0.935* | 0.735* | ||
| IgE P. Americana | -0.307* | 0.602* | 0.274* | 0.623* | 0.559* | ||
| Montería | |||||||
| Controles | Vitamina D | -0.137 | -0.362* | -0.163 | -0.048 | -0.088 | |
| IgE Total | -0.309* | 0.348* | 0.136 | 0.204 | 0.204 | ||
| IgE A. Lumb | -0.746* | 0.313* | 0.275* | 0.287* | 0.258* | ||
| IgE D. Farinae | -0.098 | 0.302* | 0.39* | 0.906* | 0.669* | ||
| IgE B. Tropicalis | -0.117 | 0.326* | 0.47* | 0.925* | 0.637* | ||
| IgE P. Americana | -0.064 | 0.268 | 0.287* | 0.483* | 0.542* | ||
| * Correlaciones con significancia estadística, valor de p<0.05. | |||||||
Para tratar de entender el comportamiento de la IgE total, se desarrollaron modelos de regresión lineal multivariados en los que se pudo identificar que los niveles de vitamina D, IgE anti-D. farinae e IgE anti-A. lumbricoides mostró la mejor correlación posible (R:0.304; p=0.05). Entre los casos la vitamina D e IgE anti-D. farinae son los posibles factores predictores de la respuesta IgE total en la población afectada por el asma alérgico (R:0.225; p<0.05). Por su parte, el modelo compuesto por vitamina D e IgE anti-P. americana se muestra entre los controles (R:0.412; p<0.05) (Cuadro 5).
| Cuadro 5. Explicación de la respuesta IGE total | |||||||
| General | |||||||
| Modelo | R | R2 | B Límite inferior | IC 95% | p | ||
| Límite superior | |||||||
| 1 | Vitamina D | 0.263 | 0.068 | -2.89 | -3.75 | -2.02 | 0.00* |
| 2 | Vitamina D | 0.294 | 0.08 | -2.85 | -3.70 | -1.99 | 0.00* |
| IgE D. farinae | 1.49 | 0.61 | 2.37 | 0.001* | |||
| 3 | Vitamina D | 0.304 | 0.09 | -2.75 | -3.61 | -1.88 | 0.00* |
| IgE D. farinae | 1.42 | 0.54 | 2.30 | 0.002* | |||
| IgE A. lumbricoides | 53.46 | 0.07 | 106.8 | 0.05* | |||
| Casos | |||||||
| 1 | Vitamina D | 0.168 | 0.028 | -1.916 | -3.186 | -0.645 | 0.003* |
| 2 | Vitamina D | 0.225 | 0.051 | -1.861 | -3.12 | -0.603 | 0.004* |
| IgE D. farinae | 1.343 | 0.355 | 2.332 | 0.008* | |||
| Controles | |||||||
| 1 | Vitamina D | 0.348 | 0.121 | -3.713 | -4.894 | -2.531 | 0.00* |
| 2 | Vitamina D | 0.412 | 0.1 7 | -3.569 | -4.722 | -2.416 | 0.00* |
| IgE P. americana | 28.918 | 14.722 | 43.114 | 0.00* | |||
| Modelos de regresión lineal, método de pasos sucesivos. | |||||||
El informe de la Estrategia mundial para la prevención y control del asma adopta el concepto según el cual la carga genética es un factor de riesgo en el asma.17 En esta entidad multifactorial, la IgE es un factor desencadenante de los eventos fisiopatológicos en la cascada inflamatoria alérgica, induciendo fenómenos iniciados por la exposición a alérgenos ambientales. Estos eventos están asociados con los niveles séricos de IgE total.18,19 Estos niveles varían cuando se estudian en diferentes grupos étnicos. En afroamericanos son más elevados que en blancos y otros grupos raciales.20,21 Actualmente se acepta que la ascendencia africana está asociada al desarrollo de asma y a la expresión de altos niveles de IgE total.10 En los brasileños, se demostraron niveles muy altos de IgE tanto en asmáticos como en individuos no alérgicos; muy probablemente debido a la alta prevalencia (83.5%) de parasitosis intestinal en esta población; situación ampliamente validada en otros grupos estudiados en las poblaciones de Suramérica, incluyendo Colombia.22-24
Los altos niveles de IgE sérica total, en pacientes de países pobres, con frecuencia indican una infección parasitaria crónica, especialmente por geohelmintos, que estimulan la producción de anticuerpos policlonales IgE. Otra posibilidad para explicar los altos niveles de IgE sérica es que estos individuos presentan una fuerte predisposición genética a la atopia, con más propensión a ser hipersensibles a alérgenos ambientales.25,26
Los asmáticos que habitan en el trópico tienen una alta sensibilización a ácaros del polvo intradomiciliario, particularmente para Blomia tropicalis (Bt) y Dermatophagoides pteronyssinus (Dp).11,27 Otra característica de estas regiones tropicales es un alto endemismo para las infecciones por geohelmintos, siendo la más frecuente la ascariasis.28-32 Se considera que la sinergia de estas características podría inducir una fuerte respuesta de anticuerpos IgE desde una temprana edad.5
La respuesta de IgE anti-Ascaris lumbricoides se ha asociado tanto con la prevalencia como con la severidad del asma alérgica.33-38 Sin embargo, no se ha aclarado si esta asociación es independiente de la exposición a los ácaros y si hay una verdadera relación causa-efecto en donde una inmumodulacion producida por epitopes de los alérgenos de AL sería la responsable de esta respuesta.10,19-23 No obstante, los datos disponibles sugieren que la ascariasis y su concomitante repuesta IgE participarían en la patogénesis del asma.5,7
Varios estudios han demostrado que los ácaros son importantes fuentes alergénicas en regiones tropicales.26,34,39 Donde las temperaturas cálidas y la alta humedad permiten el crecimiento abundante de alrededor de seis especies de importancia clínica, principalmente de D. farinae, D. pteronyssinus y B. tropicalis.40,41 En el asma, los niveles de IgE alérgeno específica contra ácaros de polvo casero, son factores predictivos mucho más importante que la IgE sérica total. Un estudio llevado a cabo en Kenia y otros realizados en diferentes países en vías de desarrollo, han mostrado que la IgE anti-ácaros del polvo doméstico se encuentra elevada tanto en el suero de sujetos asmáticos de las zonas urbanas como en los asmáticos residentes en áreas rurales.42,43
Por otra parte, la vitamina D es un inmunomodulador de la respuesta inmune. Existen dos fuentes de ella; la principal es la conversión del 7-dehidrocolesterol a pre-vitamina D3 por la luz ultravioleta-B en la exposición al Sol. La ingesta de vitamina D3 de alimentos como el pescado azul y el aceite de hígado de bacalao es la otra fuente.44 En la actualidad no hay acuerdo universal sobre el nivel sérico de Vit-D para definir deficiencia de vitamina D.15 Nuestro estudio siguió la recomendación de la OIM para definir los límites y valores aceptados: La etnia es uno de los principales factores que determinan el nivel de vitamina D.15,45,46
Hoy se acepta que concentraciones bajas de vitamina D se constituyen en un factor de riesgo para las exacerbaciones del asma (incremento en el número de hospitalizaciones y el uso de medicamentos).47 Signorello et al. informaron que el riesgo de hipovitaminosis D está igualmente asociado con variantes genéticas, homocigozidad y heterocigozidad entre individuos afrodescendientes.48
Un estudio llevado a cabo en Costa Rica reveló una asociación significativa entre las características clínicas y de laboratorio en ese grupo, la gravedad del asma y los niveles elevados de IgE total, así como la deficiencia de vitamina D.49 La literatura revela variedad de resultados en diferentes poblaciones, los cuales pueden atribuirse a los bajos niveles séricos de vitamina D en países estacionales de latitudes diferentes al trópico. Sin embargo, en los afroamericanos, la piel expresa una mayor melanizacion y puede funcionar como una barrera para la síntesis de Vit-D. Esto, sumado a las variaciones en estilo de vida, nutrición y estructura genética de dichos grupos poblacionales, pudiera explicar en parte dichos resultados.50
En los asmáticos pediátricos involucrados en este estudio, la prevalencia de insuficiencia y deficiencia de vitamina D (<30 ng/mL) fue del 13.88% en el total de individuos estudiados. En contraste, el 79.1% de los sujetos presentaron niveles séricos suficientes de vitamina D. Estos porcentajes se semejan a los de un estudio reciente con el asma infantil y vitamina D que fue realizado en una población ecuatorial como Costa Rica, en la que el 28% tenía insuficiencia de vitamina D.49 Las relativas diferencias entre nuestro estudio y la población de Costa Rica se podrían explicar en la conocida asociación de aumento de riesgo de deficiencia de vitamina D en poblaciones que viven a mayores latitudes hacia el norte.51 En general, la prevalencia de la insuficiencia Vit-D en niños con asma en nuestra cohorte es similar a la observada en la literatura cuando se estudia en poblaciones que viven en latitudes similares. Este es el primer estudio que analiza y compara la asociación entre los niveles de Vit-D y la respuesta IgE anti alérgenos de ácaros del polvo casero, anti-Periplaneta americana y anti-Ascaris lumbricoides con asma alérgica, en niños escolares pobres pertenecientes a familias que viven en comunidades marginadas en Colombia.
En resumen, nuestro estudio proporciona información importante sobre el comportamiento de los niveles de Vit-D y el asma en escolares de asentamientos pobres del Caribe colombiano.
El principal inconveniente que este estudio muestra se refiere a la falta de control sobre factores que pudieron haber modulado la síntesis de Vit-D, tales como la actividad física de los sujetos, la dieta, la duración de exposición al aire libre y por lo tanto a la luz del sol, factores que regulan la homeostasis de la vitamina D. Cohortes prospectivas son necesarias para abordar con precisión las influencias de estos factores de confusión sobre los niveles de vitamina D en esta región del Caribe. Es también necesario resaltar que todos nuestros sujetos tuvieron características socioeconómicas, clínicas y estilos de vida similares y fueron reclutados siempre por el mismo equipo de investigadores en las mismas condiciones de espacio y tiempo. De igual manera, esto valida la representatividad de nuestros controles. Por lo tanto, creemos que nuestros controles fueron también representativos de esta población pediátrica vulnerable del Caribe colombiano.
Nosotros no pudimos demostrar la asociación entre la deficiencia de vitamina D con el asma pediátrica en la cohorte estudiada. Los niveles de Vit-D fueron similares tanto en los asmáticos como en el grupo control. Los niveles de IgE total estuvieron elevados tanto en los pacientes como en los controles, lo que está en consonancia con lo descrito en la literatura sobre estudios llevados a cabo en comunidades del trópico. Se requieren otros estudios en sujetos con características socioeconómicas y de estructura genética similares para validar nuestros estudios.
Nuestros resultados también sugieren que los niveles de la vitamina D ejercerían influencia sobre la respuesta inmune mediada por anticuerpos IgE total e IgE específicas, contra alérgenos de Df, Bt, Pa y Al en una muestra de escolares asmáticos asentados en comunidades pobres marginadas de zonas endémicas para las infecciones por parasitosis intestinales.
Presentamos agradecimientos a Colciencias y la Universidad del Norte por el apoyo en la financiación de este trabajo de investigación y cada uno de los individuos y sus padres por permitirnos el desarrollo del mismo.
Este trabajo fue financiado parcialmente por Colciencias por el proyecto “Asociación de fenotipos clínicos de asma alérgica pediátrica con el polimorfismo del receptor (VDR) de la vitamina D. Identificación de variantes genéticas en escolares”. Código 121551929027 y por el proyecto ”Asociación de niveles de IgE antiAL y deficiencia de vitamina D con asma. Un estudio en pacientes pediátricos residentes en asentamientos marginados en el Caribe colombiano”. Código 121551929033.
Recibido: 2016-04-04
Aceptado: 2016-06-08
Correspondencia: Eduardo Egea. eegea@uninorte.edu.co
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons