Revista Alergia México Volumen 62, Núm. 4, octubre-diciembre, 2015.
Este artículo debe citarse como: Jiménez-Uscanga RD, Carsolio-Trujano M, Herrera-Sánchez DA, Castrejón-Vázquez MI y col. Lupus eritematoso sistémico y CD24V. Revista Alegia México 2015;62:265-270.
Recibido: 28 de mayo 2015
Aceptado: 30 de julio 2015
Lupus eritematoso sistémico y CD24V
Systemic lupus erythematous and CD24V
Rubén Darío Jiménez-Uscanga,1 Margarita Carsolio-Trujano,2 Diana Andrea Herrera-Sánchez,1 María Isabel Castrejón-Vázquez,1 Fedra Irazoque-Palacios,2 María Eugenia Vargas-Camaño,1 Nora Martínez-Aguilar,1 María del Carmen Chima-Galán3
1Servicio de Inmunología Clínica y Alergia.
2Servicio de Reumatología.
3División de Medicina Genómica.
Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, México, DF.
Correspondencia: Dra. María Isabel Castrejón Vázquez. Servicio de Inmunología Clínica y Alergia, Centro Médico Nacional 20 de Noviembre, Félix Cuevas 540, 3100 México, DF. isacastre@yahoo.com.mx
RESUMEN
Antecedentes: el lupus eritematoso sistémico es un padecimiento autoinmunitario, de origen multifactorial, con predisposición genética; más de 100 genes participan en su etiopatogenia. El gen de CD24 puede mediar varias funciones, como su actividad coestimuladora en la expansión clonal de las células T. El polimorfismo de un simple nucleótido de CD24, que resulta en un reemplazo no conservador de alanina a valina (CD24v), que precede inmediatamente al sitio de anclaje GPI (posición ω-1), condiciona la pérdida de actividad de CD24. Se ha descrito que CD24v está asociado con esclerosis múltiple y lupus eritematoso sistémico en otras poblaciones.
Objetivo: encontrar la existencia de CD24v en pacientes mexicanos con lupus eritematoso sistémico.
Material y método: estudio de genotipificación de CD24v en el que se incluyeron 64 sujetos, 32 casos con lupus eritematoso sistémico: 28 mujeres y 4 hombres; y 32 controles: 9 mujeres y 23 hombres; todos eran pacientes con lupus eritematoso sistémico del Centro Médico Nacional 20 de Noviembre, del ISSSTE, atendidos en los servicios de Inmunología Clínica y Reumatología.
Resultados: de los casos, 19 pacientes tenían genotipo homocigoto silvestre, 12 con genotipo heterocigotos y sólo un paciente mostró el polimorfismo en estado homocigoto. De los controles, 17 sujetos mostraron genotipos heterocigotos silvestres, 14 eran heterocigotos y sólo en uno se encontró que era homocigoto polimórfico. Se obtuvo una razón de momios de 0.84 y chi cuadrada de 0.17, por lo que no hubo diferencia estadísticamente significativa.
Conclusiones: se demostró que no hay diferencia estadísticamente significativa entre pacientes con lupus eritematoso sistémico y controles respecto a la existencia de CD24v.
Palabras clave: lupus eritematoso sistémico, polimorfismo de un simple nucleótido, CD24, CD24v.
ABSTRACT
Background: Systemic lupus erythematous is an autoimmune disease of multifactorial etiology with genetic predisposition. Its pathogenesis involved more than 100 genes. CD24 gene can mediate various functions such as their costimulatory activity in the clonal expansion of T cells. The single nucleotide polymorphism, resulting in a non-conservative replacement of alanine to valine (CD24v) precedes immediately GPI anchorage site (position ω-1), determines CD24 loss activity. CD24v has been associated with multiple sclerosis and systemic lupus erythematous in other populations.
Objective: To find the presence of CD24v in Mexican patients with systemic lupus erythematous.
Material and method: A study of fenotyping of CD24v included 65 subjects, 32 cases (systemic lupus erythematous): 28 women and 4 men; and 32 controls: 9 women and 23 men; cases and controls from patients with systemic lupus erythematous in National Medical Center 20 de Noviembre ISSSTE, Mexico City, services of Clinical Immunology and Rheumatology.
Results: In cases, 19 patients had a wild homozygous genotype, 12 were heterozygous and only one patient showed homozygous polymorphism. In controls, 17 showed wild heterozygous genotypes; 14 were heterozygous and 1 was found to be polymorphic homozygote. With odds ratio: 0.84 and chi cuadrada of 0.17; therefore there was no statistically significant difference.
Conclusions: Study population showed that there is no statistically significant difference between systemic lupus erythematous cases and controls with respect to the presence of CD24v.
Key words: systemic lupus erythematous, CD24, single nucleotide polymorphism, CD24v.
El lupus eritematoso sistémico es una enfermedad autoinmunitaria multisistémica, con gran variabilidad en su manifestación y curso. Su incidencia varía de manera significativa en los diversos grupos étnicos y poblaciones, con aparición anual de 1.9 a 5.6 por 100,000 habitantes. En todo el mundo, la incidencia es alta en sujetos afroamericanos, hispanos, nativos americanos y asiáticos, con predominio en mujeres, con una relación 9 a 1. El lupus eritematoso sistémico se manifiesta con síntomas constitucionales, como fiebre, pérdida de peso, fatiga, pérdida de cabello y evidencia de inflamación difusa, como linfadenopatía y hepatoesplenomegalia. La afección en la piel, en el sistema músculo-esquelético y en el renal es común, pero también puede afectar al miocardio y al aparato gastrointestinal.1,2
El diagnóstico de lupus eritematoso sistémico se basa en la existencia de cuatro o más de los siguientes criterios: eritema malar y discoide, fotosensibilidad, úlceras orales, artritis, serositis, alteración renal, trastorno neurológico, psicosis, alteraciones hematológicas e inmunológicas y anticuerpos antinucleares. En sentido inmunológico, el lupus eritematoso sistémico se caracteriza por la producción de grandes cantidades de autoanticuerpos dirigidos contra la cromatina y otros autoantígenos resultantes de la pérdida de la tolerancia en la célula B. Son numerosos los defectos genéticos que pueden afectar a la célula B en el lupus eritematoso sistémico y que afectan su activación, longevidad y apoptosis. Entre las alteraciones descritas en la célula B están: actuar como célula precursora de autoanticuerpos, presentar los autoantígenos a la célula T o participar en la organización y regulación de la respuesta inflamatoria a través de citocinas y quimiocinas, como IL-10, IL-6, INF-γ y linfotoxina alfa.1-3
La patogenia del lupus eritematoso sistémico es compleja e involucra múltiples factores genéticos y ambientales. A pesar de que todavía no se conoce por completo cuál es la participación de cada uno de estos factores, existe evidencia de agregación familiar y alta concordancia entre gemelos monocigotos,3 y se atribuye su heredabilidad a los genes que intervienen en la regulación del sistema inmunológico.4 Diversos estudios apoyan que en la patogénesis del lupus eritematoso sistémico, los genes que regulan a las células T y B tienen una contribución importante. Un ejemplo es CD24, que es una glicoproteína de superficie, expresada en una amplia variedad de tipos celulares, como las células T activadas, células B, granulocitos maduros, macrófagos y células dendríticas, entre otros.5,6
Se sabe que las moléculas de adhesión son importantes en la coestimulación de linfocitos en tejidos específicos y sitios de inflamación en los pacientes con lupus eritematoso sistémico.7-9 CD24 puede mediar varias funciones importantes, porque tiene actividad coestimuladora en la expansión clonal de células T, participa en la activación y diferenciación de los linfocitos B y modula la interacción entre el antígeno muy tardío 4, molécula de adhesión celular de la fibronectina vascular 1 (VLA-4 FVCAM-1), que se requiere para la migración de células T. Este antígeno de superficie está codificado por un gen localizado en el cromosoma 6q21, en el que se encuentra un polimorfismo de nucleótido sencillo, que consiste en una sustitución de citocina por timina en el nucleótido 226, lo que condiciona un cambio de alanina por valina en la proteína (CD24v).10-12 Este cambio, que precede al sitio de anclaje glucosil fosfatidil inositol,12,13 se ha asociado con la susceptibilidad a esclerosis múltiple y lupus eritematoso sistémico.9,13-15 Con base en los hallazgos mencionados nos propusimos investigar la existencia de CD24v en pacientes con lupus eritematoso sistémico, en una muestra de pacientes mexicanos.
MATERIAL Y MÉTODO
Estudio de casos y controles, en el que se incluyeron 64 sujetos: 32 pacientes con lupus eritematoso sistémico, diagnosticados de acuerdo con los criterios de la Academia Americana de Reumatología,14 que acudieron de manera consecutiva a los servicios de Reumatología e Inmunología Clínica y Alergia del Centro Médico Nacional 20 de Noviembre, ISSSTE, en México, DF, y 32 controles incluidos de donadores voluntarios sanos que acudieron al Banco Central de la misma institución durante enero y febrero de 2012. A todos se les invitó a participar en el estudio, previo consentimiento informado y firmado. A los pacientes seleccionados se les tomaron 3 mL de sangre total en un tubo con EDTA para la extracción de ADN genómico con la técnica utilizada en el laboratorio de Medicina Genómica, que combina el método salino y el de precipitación con cloroformo-alcohol isoamílico.14,16,17
Genotipificación
Las muestras de ADN se obtuvieron de sangre periférica, de acuerdo con un método estándar.15 La identificación del polimorfismo CD24V se realizó a través de PCR-RFLP’s, utilizando una mezcla de 50 ng/μL de ADN genómico, buffer 1x, MgCl22mM, dNTP’s 200 μM, oligonucleótidos 200 nM y 1U de taq polimerasa (Invitrogen), en un volumen final de 25 μL. Las secuencias de los oligonucleótidos usados fueron: 5’-TTGTTGCCACTTGGCATTTTTGAGGC-3’ y 3’-GGATTGGGTTTAGAAGATGGGAGAAA-5’. El protocolo de amplificación inició con una fase de desnaturalización inicial a 95°C durante 2 minutos, seguido de 35 ciclos de desnaturalización a 94°C durante 30 segundos, alineamiento y extensión a 63°C durante 30 segundos y 72°C durante 30 segundos, respectivamente; se finalizó con un paso de 5 minutos de elongación a 72°C. Para identificar la existencia del polimorfismo, el producto de la reacción en cadena de la polimerasa se sometió a digestión enzimática con Bst XI a 50°C durante 4 horas, lo que permitió el reconocimiento de los diferentes alelos por medio del análisis de RFLP’s. Los productos de la digestión enzimática se separaron en un gel de agarosa a 3% (Figura 1). En el análisis estadístico de los datos utilizados para comparar la distribución alélica y genotípica entre los grupos se usó chi cuadrada. La asociación de CD24V con lupus eritematoso sistémico se evaluó para calcular la razón de momios de cada genotipo respecto a la referencia y para cuantificar la asociación entre ambos, además de observar la posibilidad de que este polimorfismo pudiera encontrarse en ambos grupos (sanos y enfermos).17-19
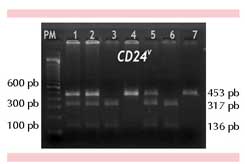
Figura 1. Genotipificación de CD24v mediante reacción en de la polimerasa de los fragmentos de restricción de longitud polimórfica (PCR-RFLPs). PM: marcador de peso molecular. Muestras 4 y 7, amplificación del segmento silvestre en estado homocigoto: CC, resistente al corte. Muestras 3 y 6: polimorfismo en estado homocigoto: TT. Muestras 1cadena, 2 y 5: genotipo heterocigoto: CT.
RESULTADOS
De 65 sujetos, se incluyeron 32 en el grupo control: 9 mujeres y 23 hombres; y en el grupo de estudio, 33 pacientes, eliminándose a una paciente por no obtenerse el ADN de su muestra sanguínea, probablemente por conteo linfocítico bajo (<500 cel/mm3). La relación mujer:hombre fue 7:1, con 28 mujeres y 4 hombres, con edad promedio de 37 años. A todos se les realizó genotipificación, cuyos resultados se comunican en el Cuadro 1, que muestra mayor concentración de homocigotos silvestres en el grupo de mujeres con lupus eritematoso sistémico y en el grupo de hombres sanos. En los heterocigotos, con mujeres con lupus eritematoso sistémico y hombres sanos, se genotipificó a ambos grupos de estudio: de los casos (con lupus eritematoso sistémico), 19 pacientes mostraron un genotipo homocigoto silvestre, 12 fueron heterocigotos y sólo en un paciente se encontró el polimorfismo en estado homocigoto. En los controles (sujetos sanos), 17 mostraron genotipos heterocigotos silvestres, 14 eran heterocigotos y en uno se encontró que era homocigoto polimórfico (Cuadro 2). Cuando se correlacionó y asoció el lupus eritematoso sistémico con la manifestación clínica y la genotipificación para determinar la existencia del polimorfismo CD24v, se estratificó como: mucocutáneo articular en siete pacientes, tres con síndrome antifosfolipídico, uno con anemia hemolítica y tres con vasculitis; dos pacientes con otras presentaciones; 16 pacientes tuvieron nefropatía, y llamó la atención que en este grupo se concentró la mayor cantidad de polimorfismos silvestres (Cuadro 3). Para comprobar si CD24v es un alelo existente en el lupus eritematoso sistémico, se realizó la prueba de razón de momios para tratar de medir el efecto del riesgo de padecer la enfermedad; se obtuvo un resultado de 0.84, que no se consideró estadísticamente significativo. Con esto se demostró que el alelo CD24v en el lupus eritematoso sistémico puede estar presente en población mexicana sin esta enfermedad. Para establecer la diferencia estadística del polimorfismo CD24v se consideró el alelo polimórfico y normal en relación con los pacientes y controles; se obtuvo chi cuadrada de 0.17. Al compararla con una significación de 0.05 y un grado de libertad (3.84), con p<0.05, no encontramos diferencias estadísticamente significativas.
|
| Cuadro 1. Genotipificación de casos y controles en el grupo total |
| Genotipos |
Casos (pacientes) |
Controles (sanos) |
|
Hombres |
Mujeres |
Hombres |
Mujeres |
| Homocigoto silvestre* |
3 |
16 |
12 |
5 |
| Heterocigoto* |
1 |
11 |
10 |
4 |
| Homocigoto polimórfico |
0 |
1 |
1 |
0 |
| Total |
4 (12%) |
28 (88%) |
23 (72%) |
9 (28%) |
| >*Mayor concentración entre mujeres y hombres. |
|
| Cuadro 2. Genotipificación del grupo total (controles y sanos) |
| Genotipos |
Casos (lupus eritematoso sistémico) |
Controles (sanos) |
| Homocigoto silvestre* |
19 (60 %) |
17 (53%) |
| Heterocigoto* |
12 (37%) |
14 (44%) |
| Homocigoto polimórfico |
1 (3%) |
1 (3%) |
| *Mayor concentración en el grupo total, sin distinción de género. |
| Cuadro 3. Correlación de lupus eritematoso sistémico con manifestación clínica y genotipificación del polimorfismo CD24v |
| Manifestación de lupus eritematoso sistémico |
Silvestre |
Heterocigoto |
Homocigoto polimórfico |
| Mucocutáneo articular |
4 |
3 |
0 |
| Anemia hemolítica |
1 |
0 |
0 |
| Síndrome de anticuerpos antifosfolipídicos |
1 |
2 |
0 |
| Vasculitis |
1 |
2 |
0 |
| Nefropatía |
12 |
3 |
1 |
| Otros |
0 |
2 |
0 |
| Total |
19 |
12 |
1 |
DISCUSIÓN
El lupus eritematoso sistémico es una de las enfermedades autoinmunitarias con mayor repercusión en todo el mundo, por la variedad de manifestaciones clínicas y el compromiso de grupos multidisciplinarios para su atención y tratamiento. En el lupus eritematoso sistémico existe la participación de interacciones celulares: células T, células B, células presentadoras de antígenos, CD80, CD86 y CD40L, entre otras, que resulta en la formación de autoanticuerpos y autoantígenos que modifican la coestimulación de las células B. El gen CD24 participa en la estimulación de las células T y en la coestimulación de las células B como parte fundamental de la producción de autoanticuerpos en el lupus eritematoso sistémico y su polimorfismo de un simple nucleótido o polimorfismo de nucleótido sencillo funcional CD24v; además, se ha reportado en otras poblaciones como factor predisponente para padecer lupus eritematoso sistémico. Sin embargo, Jin y colaboradores demostraron que las concentraciones de CD24 (hi) CD27 (+) CD19 (+) estaban elevadas en pacientes con lupus eritematoso sistémico y que estos valores disminuyeron con el tratamiento; concluyeron que también pueden ser biomarcadores útiles para evaluar la actividad del lupus eritematoso sistémico, y con ellos, vigilar la respuesta al tratamiento.18 Blair y su grupo hicieron referencia a que las células B tienen una capacidad de regulación en sujetos sanos, pero que están alteradas funcionalmente en pacientes con lupus eritematoso sistémico.19 De acuerdo con la posibilidad relativa de encontrar este polimorfismo en ambos grupos (sanos y enfermos) se utilizaron los cálculos de razón de momios para tratar de medir el efecto para el riesgo de padecer la enfermedad, al comparar los valores con lo reportado por Sánchez y su grupo, donde muestran una razón de momios de 3.16 en población española; asimismo, en población polaca, Piotrowski y colaboradores reportaron una razón de momios de 1.49; así como una razón de momios de 1.54 y 1.45 en pacientes alemanes y suecos, respectivamente.1,9,13,15-21
CONCLUSIONES
En este estudio no encontramos diferencias consideradas estadísticamente significativas, porque se reportó una razón de momios de 0.84 y chi cuadrada de 0.17, por lo que no podemos decir que sea un factor de predisposición para lupus eritematoso sistémico en población mexicana; también esta observación pudo atribuirse a que el grupo de pacientes estudiado fue pequeño. Además, nuestra población tiene gran diversidad genética, comparada con las poblaciones descritas y reportadas previamente, por lo que esto podría ser un factor determinante para la variabilidad en las regiones polimórficas asociadas con lupus eritematoso sistémico, además de que éstas son diferentes para nuestros pacientes. Es necesario un estudio con más pacientes de diagnóstico reciente, antes y después del tratamiento en mexicanos, para establecer una correlación del polimorfismo de nucleótido sencillo CD24v con lupus eritematoso sistémico.
REFERENCIAS
- Benseler SM, Silverman ED. Systematic lupus erythematosus. Rheum Dis Clin North Am 2007;33:471-498.
- Enríquez-Mejía MG. Fisiopatología del lupus eritematoso sistémico. Revista de Medicina e Investigación 2013;1:8-16.
- Sadia A, Anolik JH. B-cell biology and related therapies in systemic lupus erythematosus. Rheum Dis Clin North Am 2010;36:109-130.
- Wakeland EK, Liu K, Graham RR, Behrens TW. Delineating the genetic basis of systemic lupus erythematosus. Immunity 2001;15:397-408.
- Prokunina L, Alarcon-Riquelme M. The genetic basis of systemic lupus erythematous. Hum Mol Genet 2004;13:143-148.
- Zhou Q, Wu Y, Nielsen PJ, Liu Y. Homotypic interaction of the heat-stable antigen is not responsable for its co-stimulatory activity for T cell clonal expansion. Eur J Immunol 1997;27:2524-2528.
- De Bruijn ML, Peterson PA, Jackson MR. Induction of heat-stable antigen expression by phagocytosis is involved in vitro activation of unprimed CTL by macrophages. J Immunol 1996;156:2686-2692.
- Liu Y, Zheng P. CD24: a genetic checkpoint in T cell homeostasis and autoimmune disease. Trends Immunol 2007;28:315-320.
- Steinman L. Multiple sclerosis: a two stage disease. Nat Immunol 2001;2:762-764.
- Sánchez E, Abelson AK, Sabio JM, et al. Lupus Erythematosus Study Group. Guías de EAS de la SEMI Lupus Eritematoso Sistémico; 2011;1-60.
- Alarcón-Riquelme ME, Martín J. Association of CD24 gene polymorphism with susceptibility to systemic lupus erythematosus. Arthritis Rheum 2007;56:3080-3086.
- Rodriguez-Sánchez E. Bases moleculares del lupus eritematoso sistémico: Identificacion de marcadores genéticos. Tesis doctoral. Instituto de Parasitología y Biomedicina López-Neyra, CSIC. Universidad de Granada, España, 2008.
- Zarn JA, Jackson DG, Bell MV, Jones T, et al. The small cell lung cancer antigen cluster-4 and the leukocyte antigen CD24 are allelic isoforms of the same gene (CD24) on chromosome band 6q21. Cytogenet Cell Genet 1995;70:119-125.
- Jevsek M, Jaworski A, Polo-Parada L, Kim N, et al. CD24 is expressed by myofiber synaptic nuclei and regulates synaptic transmission. Proc Natl Acad Sci USA 2006;103:6374-6379.
- Díaz Gallo L-M. Revisiting the genetic puzzle of autoimmune disease. Tesis doctoral. Instituto de Parasitología y Biomedicina López-Neyra, Universidad de Granada, España, 2013.
- Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997;40:1725.
- Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor, NY. Cold Spring Harbor Laboratory Press, 1989.
- Jin L, Weiqian C, Lihuan Y. Peripheral CD24hi CD27+CD19+ B cells subset as a potential biomarker in naïve systemic lupus erythematosus. Int J Rheum Dis 2013;16:698-708.
- Blair PA, Noreña LY, Flores-Borja F, et al. CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic lupus erythematosus patients. Immunity 2010;32:129-140.
- Beaudet AL, Scriver CR, Sly WS, Valle D. Genetics, biochemistry and molecular bases of variant human phenotypes. In: The metabolic and molecular basis of inherited disease. 8th Ed. New York: Mc Graw Hill, 2001;3-45.
- Piotrowski P, Lianeri M, Wudarski M, Łacki J.K, et al. CD24 Ala57Val gene polymorphism and the risk of systemic lupus erythematosus. Tissue Antigens 2010;75:696-700.
