
Revista Alergia México 2014;61:363-367.
Este artículo debe citarse como: Nieto A, Nieto M, Mazón A. Progresos en el diagnóstico de la alergia. Rev Alergia Mex 2014;61:336-356.
Antonio Nieto, María Nieto Ángel Mazón
Unidad de Neumología y Alergia Infantil, Hospital La Fe, Valencia, España.
Correspondencia: Dr. Antonio Nieto nieto_ant@gva.es
El diagnóstico tradicional de la alergia mediante pruebas por punción, RAST, o ambas, ofrece información muy limitada respecto a la auténtica naturaleza de los problemas alérgicos y de sus implicaciones clínicas, terapéuticas y de pronóstico. El diagnóstico por componentes alergénicos (naturales o recombinantes) supone un gran salto cualitativo que está permitiendo gran mejoría en el diagnóstico y tratamiento de los pacientes alérgicos, porque su uso concomitante con la historia clínica y otros métodos diagnósticos in vivo e in vitro mejora de manera relevante la precisión diagnóstica.
Palabras clave: alergia, diagnóstico, diagnóstico molecular.
Si bien existen antecedentes históricos de que en el siglo XVII, en Inglaterra, se realizaron rudimentarias pruebas cutáneas con pétalos de rosa y con huevo,1 en 1869 Charles H Blackely, enfermo de rinitis alérgica, se realizó una escarificación con polen, lo que le desencadenó una violenta reacción local en el brazo.2 Ésta constituye la primera referencia respecto del diagnóstico causal más o menos sistematizado de las enfermedades alérgicas.
Obviamente, la técnica y la estandarización de los extractos han experimentado una notable progresión con el transcurso del tiempo, si bien, en esencia, las pruebas cutáneas se usan siguiendo el mismo principio formulado por Blackely hace casi 150 años. Así, las pruebas cutáneas identifican básicamente sensibilización frente a fuentes proteicas alergénicas (Cuadro 1).

En 1967, Kimishige y Teruko Ishizaka, en Baltimore, y Hans Bennich y SGO Johansson, en Uppsala, descubrieron que los hasta entonces misteriosos anticuerpos reagínicos eran, en realidad, una nueva inmunoglobulina, la IgE.1
A partir de entonces se desarrollaron métodos basados inicialmente en radioinmunoensayos y posteriormente en enzimo-inmunoensayos, capaces de detectar esos anticuerpos en el suero de los pacientes alérgicos. Ello vino a complementar de manera consistente la información obtenida mediante las pruebas cutáneas, a la vez que permitió “cuantificar” en cierto modo la “intensidad” de la alergia en un paciente determinado. Sin embargo, mediante estas técnicas in vitro se identificaban anticuerpos específicos frente a fuentes proteicas enteras (ácaros, pólenes, alimentos).
No obstante, los extractos biológicos crudos son en realidad una mezcla variable y muy heterogénea de proteínas, glucoproteínas y polisacáridos obtenidos a partir de una fuente alergénica, algunos de ellos con potencialidad alergénica pero otros no, lo que dificulta la adecuada estandarización (Cuadro 1).3 Diferentes circunstancias, como variaciones en los procedimientos de cultivo, el nivel de maduración, los tratamientos poscosechado, las diferencias en la conservación, la degradación proteolítica, las diferencias en los procedimientos de extracción, etc., afectan de manera relevante no sólo las cantidades relativas, sino también el perfil de los alergenos contenidos en la fuente proteica.4-67
Por consiguiente, parece difícil que, a partir de la fuente natural, sea posible la obtención de extractos diagnósticos in vivo e in vitro que contengan todos los alergenos relevantes y en las concentraciones adecuadas para garantizar su fiabilidad y reproducibilidad.
A partir de la aplicación de la tecnología ADN ha sido posible secuenciar y clonar moléculas con capacidad alergénica y la continua identificación de estas moléculas permitió crear una base de alergenos cada vez más completa y consistente (Cuadro 1).8,98,9 De esta manera, desde finales del decenio de 1980 ha cobrado carta de naturaleza el diagnóstico molecular (componentresolved diagnosis).10 A diferencia de los sistemas tradicionales, el diagnóstico molecular no utiliza extractos proteicos, sino únicamente alergenos naturales o recombinantes purificados, lo que permite su adecuada estandarización.
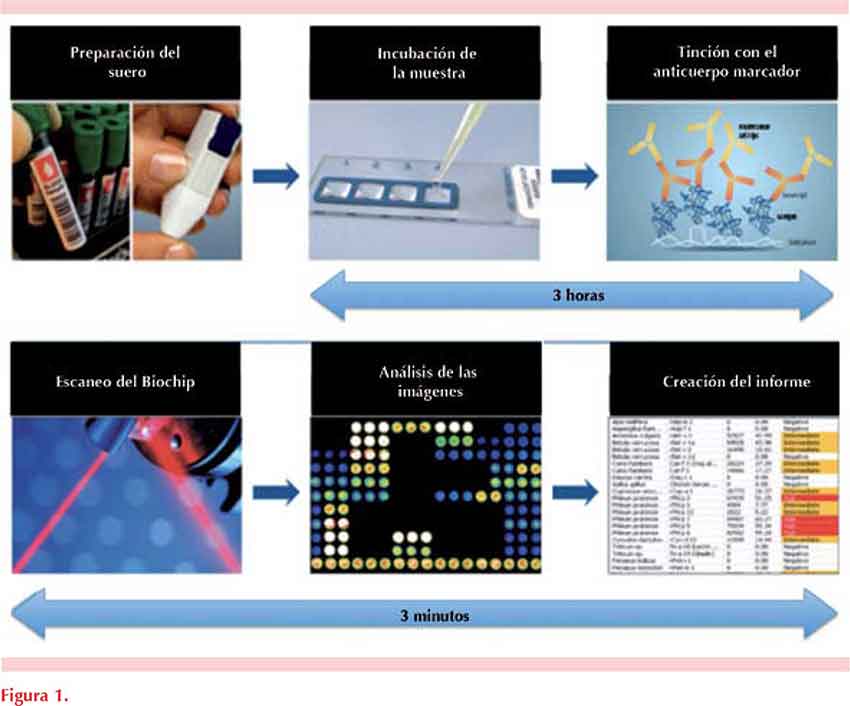
A partir de la identificación de los alergenos moleculares ha sido posible incluirlos en las herramientas diagnósticas, ya sea como componentes individuales acoplados a las matrices convencionales utilizadas para la determinación de IgE específica (ImmunoCAP® y otros) o en plataformas de microensayos que permiten la detección simultánea de IgE específica frente a más de un centenar de componentes alergénicos en una pequeña muestra de suero. La tecnología multiplex basada en microensayos del sistema ISAC (Immuno Solid-phase Allergen Chip System®, Thermo-Fisher Scientific) es un nuevo método in vitro que utiliza alergenos purificados acoplados a un microchip, que serían reconocidos por la IgE del suero del paciente y cuya interacción sería revelada utilizando un anticuerpo secundario anti-IgE acoplado a un marcador fluorescente (Figura 1).11,12
El diagnóstico molecular ha supuesto un importante avance en el diagnóstico de la alergia porque:
Aporta mayor precisión diagnóstica: permite la identificación de nuevos alergenos capaces de explicar reacciones alérgicas previamente inexplicables. Por ejemplo, el estudio de Mattsson y su grupo13 identificó un nuevo alergeno presente en la orina de los perros, la calicreína prostática (nominada por la IUIS como Can f 5) capaz de fijar IgE específica en pacientes alérgicos a perro pero que mostraban resultados negativos frente a otros alergenos de perro descritos hasta entonces (Can f 1, Can f 2 y Can f 3). En este estudio fue posible identificar la existencia en caspa de perro de una proteína análoga a Can f 5, capaz, por tanto, de inducir reacciones alérgicas en pacientes alérgicos a epitelio de perro. La introducción de este nuevo alergeno en el panel diagnóstico demostró que incluso 70% de los pacientes alérgicos a epitelio de perro tenían IgE específica frente a Can f 5 y que 38% de ellos reaccionaba únicamente frente a este nuevo alergeno y no frente a los anteriormente descritos. Por consiguiente, la introducción de este nuevo alergeno: 1) reduciría en casi 40% el número de casos falsamente negativos; 2) explicaría por qué algunos pacientes alérgicos a perro toleran los perros hembra (porque la calicreína prostática se expresa sólo en perros macho) o perros macho castrados (porque la castración reduce de manera notable la expresión de calicreína). 3) Debido a que existe una gran homología entre la calicreína prostática de perro y el antígeno prostático específico humano, no es descabellado pensar que la sensibilización a este alergeno puede aumentar el riesgo de reacciones frente a fluido seminal humano y, tal vez, estar relacionado con ciertos casos de infertilidad femenina.
Asimismo, con el diagnóstico molecular ha sido posible distinguir moléculas clínicamente relevantes de otras que, aun siendo capaces de fijar IgE, tienen una importancia clínica nula o marginal.14 También ha permitido el descubrimiento de alergenos en fuentes alergénicas insospechadas. Por ejemplo, una quitinasa de clase III en el café (Cof a 1),15 una proteína de transferencia de lípidos en el cannabis,16,17 una proteína rica en ácido glutámico (Man e 5) que reacciona de manera cruzada con Hev b 5 del látex,18 en las bayas de goji, etc.19
Asimismo, conlleva la mejor caracterización de los alergenos responsables de la alergia ocupacional,20,21 así como la identificación de nuevos alergenos en este campo, como la serpina (Tri a 33)22 y explica de manera consistente fenómenos de reactividad cruzada. Algunas proteínas con elevada homología están ampliamente distribuidas en fuentes alergénicas taxonómicamente diferentes.23,24 En este sentido, es importante tener una noción clara acerca de los conceptos contenidos en el Cuadro 2.

En el caso de fuentes proteicas vegetales, existen diferentes proteínas, pertenecientes a unas cuantas familias, que son muy ubicuas en el reino vegetal, y que están ampliamente representadas en numerosas fuentes proteicas. Las proteínas con funciones biológicas básicas tienden a estar representadas en muchas especies, de manera que las pertenecientes a la misma familia, de acuerdo con sus propiedades biológicas, suelen tener una elevada similitud estructural, compartiendo incluso epítopos capaces de fijar la misma IgE. Cuanto mayor sea su proximidad taxonómica, mayor es la probabilidad de reaccionar de manera cruzada.
Las más representativas se enumeran en el Cuadro 3, junto con sus aspectos más relevantes. Estas proteínas se denominan de manera genérica panalergenos; si bien, de manera más precisa, serían auténticos panalergenos únicamente las profilinas, porque están presentes en todo tipo de pólenes (árboles, gramíneas y malezas), así como en alimentos vegetales (frutas, verduras y hortalizas, frutos secos, legumbres y semillas) y en el látex. Otros serían euralergenos (del griego euros: amplio), como las proteínas de transferencia de lípidos, no presentes en polen de gramíneas, las PR-10, no presentes en pólenes de malezas y gramíneas, ni el látex, las polcalcinas, no presentes en látex ni en alimentos vegetales, etc., o stenalergenos (stenos: escaso), como las poligalacturonasas, las pectato-liasas o las ciclofilinas (presentes en algunos pólenes), las expansinas, los inhibidores de la alfa-amilasatripsina, las cistatinas (presentes en algunos –escasos– pólenes y alimentos vegetales) o las patatinas o las cupinas (presentes en algunos – escasos– alimentos vegetales y el látex).23

La expresión clínica en pacientes con reactividad cruzada es variable, desde reacciones graves hasta reactividad nula o clínicamente irrelevante. Ello puede depender de varios factores; en la medida en que los alergenos son proteínas, su entorno físico-químico puede influir notablemente en su alergenicidad; así, la composición química del medio, la fuerza iónica, el pH, la temperatura, etc. pueden tener una influencia notable. Asimismo, la potencia alergénica de algunas proteínas puede ser modificada por su interacción con otras proteínas.25 Los factores determinantes que pueden condicionar ese entorno pueden ser la variedad,26 el grado de maduración del alimento, las condiciones de almacenamiento y conservación y el tipo de cultivo. También son decisivos la respuesta inmunitaria del paciente, el nivel de exposición al alergeno, la alergenicidad del propio antígeno,26,27 la homología en la secuencia de aminoácidos de los epítopos responsables de la reacción, etc. Por ejemplo, como consecuencia de su elevado grado de similitud estructural, las proteínas de transferencia de lípidos suelen tener mayor probabilidad de reactividad cruzada que las profilinas, cuya homología en bastante menor. Aun así, pueden existir notables diferencias estructurales entre las proteínas de transferencia de lípidos de diferentes especies, lo que explicaría las diferencias clínicas observadas de unos pacientes a otros respecto de su reactividad frente a las proteínas de transferencia de lípidos de una o varias fuentes proteicas.25,28
En todo caso, cuanto mayor sea su grado de homología, así como su ubicuidad, más probable es que estas proteínas sean capaces de explicar cuadros de reactividad cruzada bien identificados, como:
Alergia a polen de abedul-frutas (sobre todo rosáceas, particularmente melocotón y manzana). Las PR-10 son reconocidas como proteínas de defensa que se expresan en circunstancias desfavorables para las plantas, como la exposición a contaminantes, infecciones, estrés, etc.29 Estas proteínas son responsables del frecuentemente observado síndrome de alergia oral en pacientes alérgicos a polen de abedul cuando ingieren frutas o verduras, debido a la elevada similitud estructural (28-67% de homología) del Bet v 1 del abedul con Mad d 1 de la manzana, Pru p 1 del melocotón, Pru av 1 de la cereza, Pyr c 1 de la pera, pero también con Api g 1 del apio, Cor a 1 de la avellana, así como otras PR-10 de zanahoria, albaricoque, papa, perejil, etc.29,31
Las profilinas son proteínas con peso molecular de alrededor de 14 kDa, sumamente conservadas, presentes en el citoesqueleto de los organismos eucarióticos, y que regulan el paso de actina globular a actina filamentosa cuando la célula se activa.32 Se ha secuenciado y clonado la profilina del polen de abedul (Bet v 2), pero también se han identificado profilinas en pólenes de gramíneas y de artemisia, así como en una gran variedad de alimentos de origen vegetal, incluidas las frutas rosáceas. Estas profilinas pueden tener una elevada homología (incluso de 80%) y, aunque se consideran alergenos menores, su implicación se ha demostrado en la alergia a manzana en pacientes alérgicos al polen de abedul por reactividad cruzada de la profilina del abedul (Bet v 2) con la de la manzana (Mal d 2) y otras rosáceas, así como con las de la avellana, el apio y la zanahoria.31,33 Algo similar ocurre con las sensibilización a profilina de gramíneas (Phl p 12) y las profilinas de frutas como el melocotón (Pru p 4).
Por otra parte, la familia de las PR-14 incluye las proteínas de transferencia de lípidos, que son una familia de proteínas PR con peso molecular de alrededor de 9 kDa, muy ubicuas en todo el reino vegetal, implicadas en la formación de la cutícula, en la transferencia de los fosfolípidos desde los liposomas a la mitocondria y en la defensa de la planta frente a infecciones. Por ello, se localizan preferentemente en las capas externas de las plantas y frutos, lo que explica la diferente reactividad clínica de los pacientes alérgicos a proteínas de transferencia de lípidos cuando comen fruta sin pelar o pelada. Hasta el momento se han identificado más de 60 proteínas de transferencia de lípidos en plantas y diversos productos vegetales:25 frutas rosáceas (melocotón [Pru p 3], manzana [Mal d 3], fresa [Fra a 3], cereza [Pru av 3], etc.), cítricos como la naranja (Cit s 3), hortalizas (tomate [Sola l 3], espárrago [Aspa o 1], lechuga [Lac s 1], etc.), cereales (trigo [Tri a 14], maíz [Zea m 14], etc.), frutos secos (cacahuate [Ara h 9], avellana [Cor a 9], etc.), látex (Hev b 12), lo que demuestra la gran ubicuidad de estas proteínas. Se han identificado también proteínas de transferencia de lípidos en pólenes como la artemisia y el olivo y no es infrecuente que los pacientes alérgicos a proteínas de transferencia de lípidos de frutas y verduras tengan alergia concomitante a pólenes; son precisamente éstos uno de los grupos más predispuestos a padecer reacciones más graves.34,35
Más allá de la cantidad del alergeno ingerido, la potencial intensidad de las reacciones clínicas depende, en gran medida, de la estabilidad de la proteína sensibilizante (Figura 2). Ello explicaría la existencia de diferentes perfiles de alergia a frutas rosáceas: por una parte, pacientes habitualmente del centro y norte de Europa en los que, en razón de la abundancia del abedul, la alergia a las frutas rosáceas se asocia con sensibilización a PR-10 o profilinas comunes en el polen de ese árbol y en las rosáceas. Como consecuencia de la labilidad de estas proteínas, estos pacientes sólo suelen manifestar reacciones locales, como síndrome de alergia oral. Por el contrario, la ausencia de abedules en el sur de Europa motiva que la proteína sensibilizante más común entre pacientes alérgicos a rosáceas de estas zonas suela ser la proteína de transferencia de lípidos, lo que explica la mayor severidad delas reacciones en estos casos,35 particularmente cuando comen frutas sin pelar.
Así, el diagnóstico molecular contribuye a explicar las diferencias geográficas observadas en los patrones de alergia en pacientes sensibilizados a la misma fuente proteica23,36-40 y podría ayudar a explicar también las diferencias de los perfiles clínicos a distintas edades.41,42

La sensibilización a profilinas explicaría, asimismo, las asociaciones entre alergia a polen de plantago-gramíneas y melón,43 alergia a polen de Chenopodium y melón10 y alergia a polen de ambrosia-melón-plátano.44
Síndrome artemisia-apio-zanahoria-especies, relacionado asimismo con la sensibilización a profilinas de artemisia (Art v 4), apio (Api g 4), zanahoria (Dau c 4) y especies del grupo de las apiáceas o umbilíferas, como el perejil, el cilantro, el hinojo y otras.45,46
Síndrome látex-frutas. El látex es una mezcla heterogénea de proteínas, de las que al menos 15 se han identificado como alergénicas.9 La sensibilización a uno u otro de esos alergenos induce cuadros clínicos muy distintos. Por ejemplo, se sabe que la alergia al látex es muy frecuente en pacientes multioperados, particularmente en niños con espina bífida.47,48 Sin embargo, contrariamente a lo que ocurre en otros grupos de riesgo, como el personal sanitario, los niños con espina bífida alérgicos al látex rara vez tienen una alergia concomitante a frutas. Una explicación de este hecho se apoya en que los niños con espina bífida se sensibilizan fundamentalmente por vía hematógena o trasmucosa y el alergeno sensibilizante principal es el factor de elongación del látex (Heb v 1),49,50 un alergeno muy adherente y escasamente soluble, presente en guantes y material médico (sondas, catéteres), que formaría microdepósitos capaces de inducir la sensibilización progresiva a este alergeno. Por el contrario, los adultos alérgicos al látex se suelen sensibilizar por vía inhalatoria a alergenos más aerosolizables contenidos en los productos de látex (fundamentalmente guantes). Entre éstos, la heveína del látex (Hev b 6) es uno de los alergenos reconocidos con más frecuencia por los adultos alérgicos al látex, que tienen elevada incidencia de alergia concomitante a frutas.51 La heveína posee un dominio N-terminal con gran homología con las quitinasas de clase I contenidas en el aguacate (Prs a 1), el plátano (Mus a 2), la castaña (Cas s 5), etc.52
También se han implicado en el síndrome-látex-frutas las beta 1,3-glucanasas, pertenecientes a la familia de las PR-2, presentes también en el látex (Hev b 2) y en las frutas mencionadas.53 La sensibilización a profilina del látex (Hev b 8), aunque muestra reactividad cruzada con otras profilinas de alimentos y pólenes, suele tener escasa relevancia clínica.50,54
Otras asociaciones descritas incluyen alergia-sensibilización a lenteja y coco,55 alergia-sensibilización a polen de parietaria y pistacho, alergia a polen de ciprés y melocotón, a polen de salsola y azafrán, a Alternaria y espinaca,10 a semillas de kiwi y frutos secos,56,57 a mostaza y frutos secos,58 etc.
En el caso de la cosensibilización a Alternaria y kiwi se cuestiona si sería propiamente un fenómeno de reactividad cruzada o, más bien, consecuencia de la interacción del alergeno mayor de la Alternaria (Alt a 1) con una PR-5 del kiwi, porque se han encontrado esporas de Alternaria inoculadas en la piel del kiwi, así como la existencia de Alt a 1 en la pulpa, colocalizado con una PR-5 del kiwi, probablemente con el fin de inhibir la actividad enzimática de esa proteína de defensa. Así, cabría la posibilidad de que la sensibilización al kiwi en estos casos fuera, en realidad, consecuencia de la contaminación del mismo por Alternaria.59
Pero los fenómenos de reactividad cruzada no se limitan únicamente al reino vegetal. Se han descrito síndromes de reactividad cruzada entre proteínas de origen animal (Cuadro 1):
Síndrome ácaros-invertebrados. La tropomiosina es una proteína estructural presente en el músculo de los organismos eucarióticos que comparte una elevada homología entre diferentes especies de invertebrados, como crustáceos y moluscos (cefalópodos, gasterópodos y lamelibranquios), ácaros, insectos y nemátodos, y está comúnmente implicada en fenómenos de reactividad cruzada entre estas especies.60-65
Al mismo tiempo, la sensibilización a tropomiosina de ácaros (Der p 10) o cucaracha (Bla g 7, Per a 7) explicaría la sensibilización a la tropomiosina de gamba (Pen a 1) en individuos que nunca han ingerido mariscos.66
La tropomiosina puede causar síntomas digestivos y respiratorios, y suele ser la responsable de la reactividad cruzada entre las especies mencionadas. Sin embargo, se han descrito otros alergenos potencialmente relacionados con fenómenos de reactividad cruzada entre estas especies, como la ubiquitina, la α-actinina y la arginin-cinasa, cuya relevancia en esos fenómenos varía entre climas húmedos o secos. El estudio adecuado en este sentido puede orientar acerca de la fuente sensibilizante primaria (habitualmente ácaros en climas húmedos y crustáceos en climas secos).67,68
Síndrome ave-huevo. Constituye una entidad en la que se asocian, en general, síntomas inicialmente respiratorios relacionados con la inhalación de derivados epidérmicos de aves, seguidos de síntomas alimentarios por la ingestión de yema de huevo o carne de aves de diferentes especies.69 La responsable es una proteína presente en la yema del huevo, la α-livetina (Gal d 5),70-72 que reacciona cruzadamente con albúminas de aves presentes en la carne y en las plumas.
Alergia a pescado. En la mayoría de los casos, la alergia a pescado está mediada por parvalbúminas, que son proteínas localizadas en el sarcoplasma muscular, implicadas en la señalización del calcio, y que poseen una elevada reactividad cutánea entre diferentes especies de pescado.73 Cerca de la mitad de los pacientes alérgicos a un pescado muestra reactividad cruzada, al menos, con otro.74 Por lo general, se toleran mejor los pescados azules (atún, bonito, pez espada, salmón) que los pescados blancos.75 Asimismo, la parvalbúmina puede explicar fenómenos de reactividad cruzada con carne de anfibios.76
En caso de negatividad frente a parvalbúminas, otros alergenos, como las enolasas, las aldolasas y la gelatina del pescado, pueden ser responsables en pacientes con alergia clínica a pescado.77,78
Alergia a carnes. Las albúminas son el alergeno comúnmente responsable de las alergias a carnes de mamíferos y aves, si bien ocasionalmente pueden estar relacionadas con alergenos alternativos (inmunoglobulinas, actina, miosina, tropomiosina y α-parvalbúmina).79 Es probable una mayor reactividad cruzada entre carnes de mamíferos y de aves. Se han descrito casos de alergia a leche de vaca y carne de ternera, así como reactividad cruzada con carnes de otros mamíferos en relación con sensibilización a seroalbúmina bovina (Bos d 6).80 En todo caso, la termolabilidad de las albúminas suele permitir una buena tolerancia de las carnes cocinadas.
En la medida en que las albúminas tienen un elevado grado de reactividad cruzada entre especies y que a la vez están presentes en tejidos, fluidos y epitelios de animales, pueden ocasionar problemas curiosos, como el síndrome gato-cerdo, que consiste en que pacientes con alergia respiratoria a albúmina (Fel d 2), presente en el epitelio de gato, padecen alergia alimentaria a carne de cerdo,81 u otros síndromes similares.82
Un caso diferente se debe a la sensibilización galactosa-α-1,3-galactosa (α-Gal), un determinante glucídico que se encuentra en glucoproteínas y glucolípidos de mamíferos no primates, y que se asocia con reacciones anafilácticas retardadas potencialmente graves tras la ingestión de carnes rojas. Se sospecha que la sensibilización primaria a este determinante es causada por picaduras de insectos o ciertas infestaciones parasitarias.83,84
Debido a que α-Gal también está presente en cetuximab (un anticuerpo monoclonal quimérico de ratón e IgG1 humana contra el factor de crecimiento epidérmico) prescrito en el cáncer de colon y de cabeza y cuello, se ha sugerido su administración como componente para detectar la sensibilización a α-Gal85 y, debido a que la mayoría de los pacientes alérgicos a cetuximab están previamente sensibilizados a α-Gal, se debe considerar la posibilidad de probarlo antes de su prescripción.86
Un reciente estudio identificó una secretoglobina, el heterodímero AL-CL2 de la lipofilina (Ory c 3) como un alergeno mayor del epitelio de conejo. Sin embargo, pese a su elevada homología con el alergeno mayor del gato (Fel d 1), no se ha detectado una reactividad cruzada relevante entre ambos.87
Asimismo, el diagnóstico molecular permite establecer una sospecha fundamentada respecto de la fuente sensibilizante primaria en caso de pacientes polisensibilizados. Entre las proteínas contenidas en una fuente alergénica, algunas son específicas de especie y, como se mencionó, otras son proteínas homólogas presentes en varias fuentes alergénicas.10,88 Así, la sensibilización a proteínas específicas indicaría la sensibilización genuina a esa fuente proteica; al ser Ara h 2 un alergeno específico de especie, indicaría una sensibilización genuina a cacahuate.88-90 A su vez, la sensibilización a alergenos de reactividad cruzada tendría implicaciones con importantes repercusiones respecto de la conducta a seguir en un paciente concreto (Cuadro 4), particularmente en lo que se refiere a la indicación de inmunoterapia específica. En todo caso debe insistirse en que sensibilización no necesariamente implica relevancia clínica.

El diagnóstico molecular ha mejorado sensiblemente la precisión diagnóstica en los casos de alergia a veneno de himenópteros91-93 con vistas a la adecuada valoración de los riesgos y prescripción de inmunoterapia específica.
El uso de las plataformas multiplex (ISAC®) puede ayudar a aclarar algunos casos sospechosos de alergia en los que no ha sido posible hallar un alergeno potencialmente responsable, o casos de anafilaxia idiopática, al determinar de manera simultánea más de 100 alergenos cuya determinación individual in vivo e in vitro sería complicada.94
Además, se han descrito sensibilizaciones (generalmente asintomáticas o asociadas con reacciones locales leves) ante determinantes carbohidratados con reactividad cruzada (Cuadro 3), presentes en glucoproteínas de pólenes (ambrosía, Phleum y abedul), de alimentos de origen vegetal (frutos secos, verduras, hortalizas, cereales, frutas)27 y también de insectos (abejas, avispas y cucarachas). En todo caso, el papel de los determinantes carbohidratados con reactividad cruzada como potencial elemento responsable de reacciones de reactividad cruzada clínicamente relevantes sigue siendo controvertido,95-98 entre otras razones porque muchas glucoproteínas contienen un único determinante carbohidratado con reactividad cruzada capaz de fijar IgE, por lo que no sería posible el efecto de puenteo en dos moléculas de IgE acopladas a la membrana celular para inducir la liberación de mediadores por parte de mastocitos y basófilos.95 El progreso en la caracterización de estas glucoproteínas, que identifiquen las que contengan más de un determinante carbohidratado con reactividad cruzada, permitirá determinar cuáles podrían estar relacionadas con fenómenos de reactividad cruzada con un efecto clínico real.
El diagnóstico molecular permite efectuar aproximaciones de pronóstico más precisas, así como mejorar la seguridad de otros procedimientos diagnósticos comúnmente utilizados, como las pruebas de provocación. En este sentido, la mera positividad, así como la intensidad de la positividad frente a determinados componentes alergénicos puede resultar de utilidad respecto de la valoración de: a) la cronología del progreso de la alergia desde sensibilización a alergia clínica, b) la posibilidad de poder superar la alergia, c) el riesgo de tener reacciones en una prueba de provocación, d) el riesgo de reacciones en relación con la forma de preparación del alimento administrado, e) el riesgo de reacciones más graves.
Por ejemplo, a partir del análisis de una secuencia de sueros de niños incluidos en la cohorte MAS utilizando el diagnóstico molecular ha sido posible determinar que, probablemente, la sensibilización a un alergeno específico precede incluso tres años las manifestaciones clínicas, mismas que con frecuencia se producen cuando el nivel de sensibilización ha aumentado de manera relevante, y que a veces se acompaña de sensibilización concomitante a otros alergenos de la misma u otra fuente alergénica.99
Hay estudios que sugieren que la sensibilización a determinadas proteínas implica menor probabilidad de superar el problema y viceversa. Por ejemplo, la sensibilización a Ara h 8 supone una muy elevada probabilidad de remisión de la alergia a cacahuate.100
Por su parte, la sensibilización a ovomucoide (Gal d 3) implica mayor riesgo de persistencia de la alergia a huevo.101-103
El diagnóstico molecular también resulta útil al momento de planificar la conveniencia de realizar una prueba de provocación en pacientes con anafilaxia inducida por ejercicio dependiente de la ingestión de trigo.104 Un estudio reciente analizó el cociente IgE específica frente a ω-5-gliadina/IgE total en pacientes con alergia a trigo y estableció un punto de corte que delimitaría los pacientes con probabilidad de tener síntomas graves (anafilaxia) cuando ingieren productos con trigo (cociente superior a 0.3) de los que sólo manifestarían síntomas leves (urticaria, síntomas digestivos, dermatitis atópica).105
De manera similar, se ha propuesto que un cociente IgE específica frente a Ara h 2/IgE específica frente a cacahuate mayor de 0.6 sería predictor de reacciones graves tras la ingestión de cacahuate.39
La sensibilización a Gly m 4 implica riesgo de reacciones generalizadas y graves por el consumo de soja.106 En el caso de la avellana, la sensibilización a proteínas de almacenamiento Cor a 9 y Cor a 11 sería responsable de reacciones más graves, comúnmente en niños, mientras que la sensibilización a una PR-10 homóloga al Bet v 1 (Cor a 1.04) predominante en adultos se asociaría con síndrome de alergia oral.107 Asimismo, concentraciones de IgE específica ≥ 1 kU/L frente a Cor a 1 o ≥ 5 kU/L frente a Cor a 14 en niños y ≥ 1 kU/L frente a Cor a 1 o ≥ 1 kU/L frente a Cor a 14 en adultos tienen especificidad mayor de 90% en la predicción de síntomas objetivos tras la prueba de provocación.42
En general, se acepta que la sensibilización a proteínas de transferencia de lípidos implica mayor riesgo de reacciones graves,34,108 aunque hay quien cuestiona esta aseveración.109,110
Respecto de la leche de vaca, la sensibilización a caseína (Bos de 8) se ha relacionado con la persistencia de la alergia, en razón de su mayor termoestabilidad en comparación con las proteínas del suero de leche. Así, un estudio reciente estableció puntos de corte de 0.94 y 20.2 kU/L frente a Bos d 8 para unas respectivas sensibilidad y especificidad de 95%, con un punto de corte óptimo de 4.95 kU/L (sensibilidad 74%, especificidad 77%).111 Aun así, el caso de la alergia a la leche de vaca también resulta controvertido, porque hay estudios que concluyen que, si bien la concentración de IgE específica frente a leche se relaciona inversamente con la probabilidad de alcanzar la tolerancia, la determinación individualizada de IgE específica frente a α-lactalbúmina, β-lactoglobulina (Bos d 5.0102), κ-caseína y α(s1)-caseína no aporta información adicional al respecto, lo que cuestionaría la justificación del diagnóstico molecular en este caso.112
Otro estudio efectuado en pacientes alérgicos a cacahuate estableció un punto de corte de 1.63 kU/L frente a Ara h 2 para establecer la recomendación de realizar o no una prueba de provocación, lo que permitió reducir de 205 provocaciones estimadas en el caso de no haber utilizado este método, a únicamente 92.113 Sin embargo, otros estudios cuestionan la verosimilitud de esta conclusión en el caso concreto de la IgE específica frente a cacahuate y Ara h 2,114 además de que dan puntos de corte distintos (Ara h 2 < 0,35 kU/L).89
La relación de la gravedad de las reacciones con la sensibilización a determinados alergenos no ocurre solamente en el caso de los trofoalergenos, sino también en el de los aeroalergenos. Por ejemplo, la sensibilización a Per a 2 de Periplaneta americana se correlaciona con asma más grave y elevación de citocinas y quemoquinas proinflamatorias séricas (IL-8, proteína quimotáctica de monocitos 1 y ligando 20 de quemoquinas), en comparación con la sensibilización a Per a 9 en pacientes alérgicos a cucaracha.115
Asimismo, la probabilidad de tener síntomas se relaciona también con el hecho de que el alimento se haya administrado crudo o cocinado y, más allá del efecto desnaturalizador que la propia cocción tiene en las proteínas (en relación directa con su termolabilidad), también depende de cómo se cocinó el alimento. Por ejemplo, un estudio sugiere que la cocción de huevo con trigo a 180ºC durante al menos 10 minutos induce la formación de agregados insolubles Gal d 3-gluten de baja alergenicidad.116 A su vez, hay estudios que establecen una relación directa entre las concentraciones de IgE específica frente a Gal d 3 y la tolerancia a huevo cocido o crudo102 y que la probabilidad de tolerar el huevo cocido sería superior a 95% cuando la IgE frente a Gal d 3 sea menor de 1.2 kU/L.117 Por el contrario, las probabilidades de tener una reacción frente a huevo horneado serían superiores a 90% cuando el paciente tiene una IgE específica frente a Gal d 3 superior a 50 kU/L.118 Otro estudio muy reciente demostró que la cocción del cacahuate disminuye la existencia de alergenos, particularmente Ara h 2, 6 y 7 y, en consecuencia, su alergenicidad,119 mientras que el tueste la aumentaría.120
Por todo ello, si bien la disponibilidad de puntos de corte frente a fuentes proteicas o alergenos específicos puede ser de utilidad para tomar la decisión respecto de realizar o no una prueba de provocación, de si debe realizarse con el alimento crudo o cocinado, respecto del método de cocinado, respecto de establecer un pronóstico acerca de la probabilidad de superar la alergia o de cuándo podría ocurrir, la cautela es esencial, porque las probabilidades de que esos sucesos tengan lugar dependen de factores individuales imponderables relacionados con el alimento y con la respuesta del propio paciente. Así pues, el diagnóstico molecular nunca puede sustituir a la evaluación individual basada en la historia clínica y en la experiencia del médico.
Asimismo, el diagnóstico molecular permitiría una orientación terapéutica más adecuada y precisa, desde el punto de vista de las recomendaciones de medidas de prevención y de la prescripción de fármacos e inmunoterapia específica.
Algunos comentarios apuntados con anterioridad pueden servir de ejemplo. Así, una monosensibilización a Can f 5 permitiría, en teoría, la convivencia con perros hembra o con perros macho castrados13 y los pacientes alérgicos a seroalbúmina de perro (Can f 3), por reactividad cruzada con seroalbúmina bovina (Bos de 6), tolerarían la presencia de un perro. Ello ayudaría también respecto de los consejos dietéticos en pacientes con alergia alimentaria: por ejemplo, algunos pacientes alérgicos a huevo podrían tolerar el huevo cocido117 o cocinado con harina de trigo;116 los pacientes alérgicos a la seroabúmina podrían tolerar carnes bien cocinadas;81 es muy improbable que los pacientes alérgicos a látex monosensibilizados a Hev b 1 tengan problemas con la ingestión de frutas;51 los alérgicos a profilinas probablemente sólo tendrían síndrome de alergia oral, mientras que los alérgicos a proteínas de transferencia de lípidos tendrían un riesgo potencial de reacciones más graves, aunque cabría la posibilidad de que toleraran la fruta pelada.121
Un estudio reciente efectuado en 86 adultos con alergia alimentaria demostró que el diagnóstico molecular cambió significativamente la decisión del médico de prescribir adrenalina, en comparación con el mero criterio clínico.122
El diagnóstico molecular orientaría la correcta prescripción de la inmunoterapia específica, no sólo en cuanto a la composición del extracto, sino respecto a su indicación o no porque, en comparación con el criterio clínico habitual basado en las pruebas cutáneas y la IgE específica frente a fuentes alergénicas, el diagnóstico molecular modificaría la prescripción de la inmunoterapia específica en cerca de la mitad de los pacientes, al menos en áreas con sensibilización compleja a pólenes,123-126 particularmente en pacientes polisensibilizados (Cuadro 4).127,128
También permitiría ahorrar en inmunoterapia específica innecesaria en pacientes sensibilizados a alergenos contenidos en fuentes alergénicas, pero que no están presentes de manera estandarizada en los extractos comerciales disponibles para inmunoterapia específica.129
Otra posibilidad que se abre a partir del diagnóstico molecular sería el tratamiento de síndromes de reactividad cruzada por sensibilización a panalergenos:
Síndrome de sensibilización a profilina: un estudio previo sugirió que un año de inmunoterapia específica con polen de abedul en pacientes con alergia concomitante frente a polen de abedul y síndrome de alergia oral por manzana era capaz de aliviar de manera relevante los síntomas clínicos inducidos por la ingestión de esta fruta.130,131
Síndrome de sensibilización a proteínas de transferencia de lípidos: está comercializada una vacuna sublingual con proteínas de transferencia de lípidos (Pru p 3) de melocotón, cuyos resultados preliminares resultan esperanzadores.132-134 Existen también en marcha estudios de la administración de inmunoterapia específica subcutánea frente a proteínas de transferencia de lípidos recombinante de melocotón (rPru p 3) y parvalbúmina recombinante de carpa (rCyp c 1), cuyos resultados están pendientes de publicarse.
Asimismo, gracias a la tecnología ADN ha sido posible caracterizar y clonar alergenos recombinantes en cantidad suficiente para poder utilizarse en inmunoterapia específica. Inicialmente comenzaron a aislarse alergenos naturales purificados o alergenos recombinantes que emulaban los alergenos naturales. Pero la tecnología recombinante también permitió la fabricación de alergenos hipoalergénicos, proteínas alergénicas híbridas y péptidos de células T, cuyo objetivo sería mejorar la eficacia y seguridad de la inmunoterapia específica, así como disminuir el número de inyecciones.14 Así, hay estudios que analizan los resultados de:
• Vacunas basadas en alergenos recombinantes no modificados.
• Vacunas con alergenicidad reducida y reactividad de células T mantenida, mediante: a) el cambio o la destrucción de los epítopos conformacionales o la oligomerización de los alergenos, b) la modificación del plegamiento del alergeno por reducción o alquilación, c) la introducción de mutaciones puntuales por mutagénesis dirigida de las cisteínas, a fin de romper los puentes disulfuro, inducir la eliminación de partes de secuencias y provocar la fusión de variantes alergénicas. Esta forma aún no se ha administrado en pacientes.
• Vacunas basadas en péptidos de células T, carentes de los epítopos conformacionales fijadores de IgE.
• Vacunas basadas en derivados alergénicos con reducción de la reactividad IgE y de células T, basadas en el principio haptenoportador. Los péptidos alergénicos no IgE-reactivos (de 25-40 aminoácidos) son acoplados covalentemente a proteínas transportadoras (por ejemplo, proteínas virales), lo que induce la producción de IgG alergeno-específica con ayuda de las células T dirigidas contra la proteína portadora.14
Como consecuencia de ello, la prescripción de estos alergenos recombinantes en inmunoterapia específica permitiría: a) la posibilidad real de inmunoterapia “a la carta”, porque sería posible la prescripción de alergenos purificados adaptados al perfil clínico de cada paciente concreto; b) la posibilidad de administrar “cócteles” de varios alergenos a dosis terapéuticas en pacientes polisensibilizados, con lo que se evitaría el efecto dilucional muy habitual en las mezclas actuales; c) la eliminación real de componentes (alergénicos o no) irrelevantes o innecesarios, potencialmente capaces de inducir sensibilizaciones indeseadas y posibles efectos adversos.135
El diagnóstico tradicional mediante pruebas por punción, RAST, o ambas, ofrece información muy limitada respecto a la auténtica naturaleza de los problemas alérgicos y de sus implicaciones clínicas, terapéuticas y de pronóstico.
El diagnóstico por componentes alergénicos (naturales o recombinantes) supone un gran salto cualitativo que permite gran mejoría en el diagnóstico y tratamiento de los pacientes alérgicos, porque su uso concomitante con la historia clínica y otros métodos diagnósticos in vivo e in vitro mejora de manera relevante la precisión diagnóstica,136 lo que probablemente inducirá un notable ahorro global.
Los problemas no resueltos relacionados con el diagnóstico molecular son:
•Las plataformas multiplex de diagnóstico molecular originan, en ocasiones, un problema de sobreinformación porque con frecuencia aparecen resultados cuyo significado desconocemos, que deberá desentrañarse con el transcurso el tiempo. Se han propuesto algoritmos o protocolos137 e, incluso, sistemas informáticos expertos138 para ayudar en la interpretación de los resultados.
•El diagnóstico siempre debe hacerse en el contexto de la historia clínica del paciente, porque sensibilización no necesariamente implica alergia relevante en términos clínicos.10
•Aun cuando el diagnóstico molecular puede ser de gran ayuda para reducir la indicación de pruebas de provocación,124 éstas siguen siendo el patrón de referencia diagnóstico,139 especialmente en casos dudosos o intermedios, porque los puntos de corte para indicar la provocación en la mayoría de los casos están por establecerse y varían de unos estudios a otros, probablemente en relación con diferencias en las poblaciones incluidas, con la edad del paciente e, incluso, de un paciente a otro.
•Las condiciones de la prueba con frecuencia difieren de las que se dan en la exposición natural al alergeno, lo que implica diferencias en la conformación de la estructura cuaternaria de la proteína y, por tanto, de cambios en la exposición de epítopos, lo que podría explicar los resultados falsos negativos en pacientes reactivos in vivo.25,140
El diagnóstico epitópico podría contribuir a resolver algunos de los problemas anteriores y será probablemente el próximo paso en el progreso diagnóstico in vitro de la alergia.65,78,141-146