Revista Alergia México Volumen 62, Núm. 4, octubre-diciembre, 2015.
Este artículo debe citarse como: Sánchez J, Caraballo L. Repercusión de la contaminación del aire en la aparición de asma. Revista Alegia México 2015;62:287-301.
Recibido: 20 de mayo 2015
Aceptado: 30 de julio 2015
Repercusión de la contaminación del aire en la aparición de asma
Impact of air pollution on the development of asthma
Jorge Sánchez,1,2,3 Luis Caraballo2,3
1Grupo de Alergología Clínica y Experimental (GACE), IPS Universitaria, Universidad de Antioquia, Medellín, Colombia.
2Grupo de Alergología Experimental e Inmunogenética, Instituto de Investigaciones Inmunológicas, Universidad de Cartagena, Cartagena, Colombia.
3Fundación para el Desarrollo de las Ciencias Médicas y Biológicas (FUNDEMEB), Cartagena, Colombia.
Correspondencia: Dr. Jorge Sánchez. jotamsc@yahoo.com
RESUMEN
La contaminación del aire influye en el origen y la evolución de las enfermedades respiratorias. El incremento en la frecuencia que ha tenido el asma en los últimos años se asocia con el aumento de los contaminantes atmosféricos y es secundario a la liberación de gases y pequeñas partículas producidas a partir de la combustión de derivados del petróleo, humo de cigarrillo, etcétera. Se conocen algunos mecanismos acerca de cómo estos contaminantes pueden influir en el asma y otras enfermedades alérgicas: 1) al actuar como irritantes en las células alveolares o epiteliales, 2) por su acción coadyuvante en los alergenos en el proceso inflamatorio y 3) por mecanismos epigenéticos. En esta revisión trataremos los mecanismos fisiopatológicos por los que los contaminantes del aire se convierten en factores de riesgo de asma y otras enfermedades alérgicas.
Palabras clave: aire, contaminación, coadyuvante, alergeno, asma, estrés oxidativo, inflamación.
ABSTRACT
Air pollution affects the origin and evolution of respiratory diseases. The increased frequency of asthma in recent years has been associated with growth air pollutants and small particles produced from the combustion of petroleum or cigarette smoke. Some mechanisms of how these contaminants can influence asthma and other allergic diseases are known: 1) acting as irritating on alveolar epithelial cells, 2) actin as adjuvant for allergens inflammation, 3) and epigenetic mechanisms. In this review, we discuss the pathophysiological mechanisms by which air pollutants become risk factors for the development of asthma and other allergic diseases.
Key words: air pollution, adjuvant allergen, asthma, oxidative stress, inflammation.
ANTECEDENTES
La prevalencia del asma es alta1-3 y su aumento en los últimos años está relacionado con cambios en las conductas sociales de los seres humanos y de las condiciones ambientales consecuentes, como el aumento de los contaminantes en el aire.4 La principal fuente de alergenos inductores de asma en los países del trópico son los ácaros; entre ellos, Blomia tropicalis,5,6 Dermatophagoides pteronyssinus y Dermatophagoides farinae.7,8 Numerosos estudios mostraron asociación entre las enfermedades alérgicas, especialmente el asma, y la alta exposición a gases como ozono (O3), dióxido de nitrógeno (NO2) y las partículas de pequeño tamaño (PM).9-12
Para facilitar su estudio, se dividió a los contaminantes según sus propiedades intrínsecas y sus fuentes (Cuadro 1), pero debido a que la población general está expuesta a todos ellos al mismo tiempo, se hace difícil evaluar el riesgo que confiere cada uno de manera individual. A pesar de esto, estudios in vitro y en modelos múridos demostraron que los gases pueden desencadenar por sí solos una respuesta inflamatoria en la zona pulmonar y exacerbar las crisis respiratorias en los sujetos asmáticos, lo que lleva a mayor número de consultas de urgencias, especialmente en la población infantil.13-18 El efecto nocivo no sólo se limita a su acción irritante, sino que actúa por otros mecanismos que inducen la respuesta alérgica, al facilitar la sensibilización a los alergenos. Los gases y partículas pueden inclinar la respuesta inmunitaria a un perfil Th2 en edades tempranas; los trabajos de Skorge, Pinkerton y otros investigadores muestran que la exposición al humo de cigarrillo en la etapa fetal o neonatal aumenta la incidencia de asma en la edad adulta, lo que indica que el periodo intrauterino y la infancia son los más susceptibles.19,20
| Cuadro 1. Clasificación de los contaminantes aéreos de acuerdo con su origen, fuente y tipo de composición |
| Origen |
Primarios |
Contaminantes emitidos directamente a la atmósfera: SO2, algunas especies de NO, CO y partículas de pequeño tamaño |
| Secundarios |
Contaminantes que se forman como resultado de reacciones químicas entre otros contaminantes: O3 NO y algunos tipos de partículas |
| Fuente |
Intradomiciliaria |
Cocinar, material de las casas, humo de cigarrillo, productos de consumo, productos de aseo |
| Extradomiciliaria |
Industrias, automóviles, fuentes naturales |
| Tipo |
Gases |
SO2, NO2, NO, ozono, CO (ejemplo: hidrocarburos aromáticos, dioxina, benceno, aldehído) |
| Partículas |
Partículas burdas (PM10), finas (PM2.5) y ultrafinas (PM0.1). El tamaño de las partículas se mide en micrómetros |
| VOC: componentes orgánicos volátiles; SO2: dióxido de azufre; NO2: dióxido de nitrógeno; NO: óxidos de nitrógeno; O3: ozono. |
En la población atópica, muchos polimorfismos genéticos localizados en diversos cromosomas, especialmente 2, 4, 12 y 22, se asociaron con la evolución de enfermedades alérgicas posterior a cla inhalación de partículas normalmente no dañinas en la población general. Por el contrario, en otras poblaciones, como China, donde los niveles de contaminación del aire son altos, la frecuencia de las enfermedades respiratorias alérgicas es comparativamente más baja.21,22 En esta revisión abordaremos a profundidad los mecanismos por los que los contaminantes promueven la aparición de las enfermedades alérgicas, en especial el asma, al describir algunos mecanismos epigenéticos y los polimorfismos asociados con menor tolerancia a los contaminantes.
Efecto irritante y respuesta inmunitaria innata
Por lo general, los componentes del aire entran en contacto con los organismos a través de la piel y las mucosas; las vías respiratorias son la vía principal y la más sensible.23 La inhalación de los contaminantes atmosféricos, gases o partículas da como resultado un aumento en las citocinas, las quimiocinas proinflamatorias, los neutrófilos, los linfocitos B y los macrófagos alveolares, que ocurre en la población general ante exposiciones prolongadas o ante concentraciones altas de contaminantes (Figura 1). Aunque varios países han propuesto concentraciones y tiempos de exposición “tolerables” para cada contaminante, de acuerdo con lo observado en la mayoría de la población; estos valores, por lo general, son superiores a los tolerados por pacientes con asma.
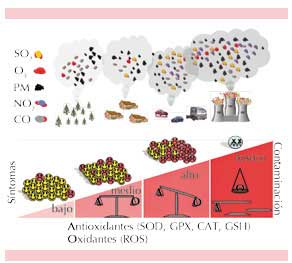
Figura 1. Respuesta de la población ante la contaminación del aire. Una concentración alta y un tiempo de exposición largo a los contaminantes aumentan los síntomas respiratorios en la población general; sin embargo, esta respuesta depende también de la capacidad de cada persona de producir enzimas antioxidantes que contrarresten el estrés oxidativo de la contaminación aérea. SOD: superóxido dismutasa; GPX: glutatión peroxidasa; CAT: catalasas; GSH: glutatión; ROS: especies reactivas de oxígeno.
Gases como ozono (O3), óxidos de nitrógeno (NOx), dióxido de azufre (SO2) y partículas de tamaño inferior a 10 micras (PM), al liberar radicales libres en las células epiteliales o en los macrófagos alveolares inducen la síntesis de interleucina (IL-1), factor de necrosis tumoral alfa (TNF-a), factor estimulante de colonias de granulocitos y mastocitos (GM-CSF) e interleucina 8 (IL-8); además, aumentan la actividad quimiotáctica de los neutrófilos y los eosinófilos.24-27
Aunque estos procesos se conocen desde hace varios años, a principios del decenio de 1990 empezaron a describirse los mecanismos desencadenantes. La hipótesis del “modelo del estrés oxidativo jerárquico” explica el efecto irritante de los contaminantes.28 La propuesta inicial sólo en cuanto a las partículas producidas por la combustión del diésel ahora es aceptada respecto de todos los contaminantes, y propone lo siguiente: con exposiciones bajas de contaminantes atmosféricos ocurre la formación de especies reactivas de oxígeno, como superóxido (O2) e hidróxido (OH); pero esto es compensado rápidamente por el incremento de enzimas como la superóxido dismutasa, glutatión reducido, glutatión peroxidasa y catalasas (Figura 2). La producción de las especies reactivas de oxígeno parece ocurrir como parte de una respuesta celular a las partículas y compuestos químicos que logran entrar en las células epiteliales o en los macrófagos.29 Los miembros de la superfamilia glutatión S transferasa son críticos para proteger las células de la acción de las especies reactivas de oxígeno.30 Cuando el ozono es inhalado, reacciona con los ácidos grasos insaturados de las membranas de las células de la vía aérea y puede formar aldehídos e hidroxiperóxidos, que son rápidamente regulados por la glutatión S transferasa P1 (GSTP1) y glutatión S transferasa M1 (GSTM1).31 En modelos de ratones se observó que la enzima catalasa se activa por el peróxido de hidrógeno presente en el combustible diésel y, además, su acción antioxidante se potencia si se administran vitaminas antioxidantes, lo que resulta en disminución de la respuesta inflamatoria producida por las partículas producidas por la combustión del diésel.31

Figura 2. Modelo del estrés oxidativo. Cuando las células del epitelio alveolar entran en contacto con los gases y partículas aumenta la expresión de enzimas antioxidantes y se bloquean las vías proinflamatorias (epitelio [A]), pero cuando la respuesta antioxidante es insuficiente, hay un aumento de la expresión de mediadores y de activación de células proinflamatorias (epitelio [B]). Ma: macrófago; Nu: neutrófilo; CD: célula dendrítica; GSH: glutatión reducido; GSSG: glutatión oxidado; ROS: radicales libres de oxígeno; JNK: jun cinasa N terminal; AP-1: activador principal 1; NF-kB: factor nuclear kappa B; IkB: inhibidor kappa B; g-GCS: gamma glutamicisteinil sintetasa; HO-1: hidróxilo 1; MnSOD: superóxido dismutasa mitocondrial; IL: interleucina; iNOS: óxido nítrico sintentasa 1; TNF-a: factor de necrosis tumoral alfa; ICAM-1: moléculas de adhesión intercelulares 1; VCAM-1: moléculas de adhesión vascular 1.
Cuando la exposición a las partículas o los gases ambientales es alta, la producción de las enzimas antioxidantes no es suficiente para compensar el efecto irritante; las partículas de carbono disminuyen la actividad de las enzimas antioxidantes de manera dosis dependiente y otras moléculas, como los compuestos orgánicos que están en su superficie, pueden actuar como inhibidores específicos; un ejemplo son las quinonas que están en las partículas producidas por la combustión del diésel, que inhiben la actividad de la superóxido dismutasa.32 Los superóxidos pueden lesionar las membranas celulares de manera directa, pero también pueden activar vías de transcripción mediadas por el factor nuclear kappa B (NF-kB) y el antígeno principal 1 (AP-1), lo que aumenta la expresión de genes de citocinas y quimiocinas proinflamatorias, con el consecuente aumento en el infiltrado celular, la secreción de moco y la broncoconstricción; todo esto produce un ciclo de propagación, porque a mayor liberación de mediadores proinflamatorios, mayor liberación de especies reactivas de oxígeno.33
Los trabajos realizados por Ladan Fakluzadeh34,35 y Hye Youn ChO36 muestran que entre los mecanismos que explican los daños causados por los gases y las partículas, el factor nuclear NF-kB, especialmente la subunidad p56 y el factor C/EBP (CCAAT/enhancer-binding protein), regulan la baja producción de IL-10, elevan las concentraciones de TNF-a, aumentan la producción de NO2 a partir de la óxido nítrico sintetasa 2 (NOS-2) y aumentan la expresión de ciclooxigenasa 2 (COX-2) (Figura 2). Estudios realizados en ratones indican que la mayor permeabilidad en los pulmones como resultado de la exposición a gases (CO, O3, NO2) estaría mediada, al menos en parte, por los receptores toll like 4 (TLR-4).37 Este receptor respondería a los gases al incrementar la expresión de óxido nítrico sintasa y la producción de NO2, lo que terminaría en incremento del proceso inflamatorio y de la lesión tisular.
Aunque no existe un umbral claro que permita predecir cuándo la exposición a un contaminante, sea aguda o crónica, produciría síntomas, está claro que los asmáticos son más susceptibles que la población general a los efectos de los contaminantes; así, exposiciones controladas a componentes orgánicos volátiles durante cuatro horas en cantidades inferiores a las que pueden ser percibidas por el olfato (<50 mg/m3) producen molestias respiratorias y disminución de la fuerza espiratoria en personas con asma, a diferencia de las personas sin asma, que no tienen ningún tipo de síntomas.25,38 También se observó que una exposición de sólo 30 minutos a NO2 en niveles atmosféricos aumenta la respuesta inflamatoria a SO2 en sujetos asmáticos debido tal vez a un efecto sinérgico entre estos gases.24,28,39 Abe y colaboradores midieron la liberación de citocinas inflamatorias en las células del epitelio bronquial, luego de la exposición a diésel con y sin partículas de pequeño tamaño; las células que recibieron sólo el componente gaseoso del diésel tuvieron menor expresión de citocinas que las expuestas a gases y partículas.39 Estos resultados hacen pensar que a mayor número de contaminantes, mayor efecto irritante; tal vez porque actúan por mecanismos diferentes que se potencian entre sí.
En modelos experimentales en ratones, la exposición a ovoalbúmina junto con 0.1 mg de lipopolisacáridos bacterianos, que son el ligando natural de los TLR-4, tuvo como resultado una sensibilización IgE a ovoalbúmina.40 Lura Novak y colaboradores41 observaron, además, que al exponer a los ratones con ozono y ovoalbúmina se necesitaron concentraciones menores de ésta que las requeridas sólo con ovoalbúmina y que el ozono inducía la migración de macrófagos y células dendríticas. Sin embargo, en un modelo con ratones carentes de TLR-4, éstos eran inmunes a la sensibilización con ovoalbúmina, incluso a dosis altas de ésta y de ozono, lo que indica que el ozono y tal vez otros contaminantes participan en la sensibilización IgE por un mecanismo dependiente del TLR-4. Otros estudios muestran que la sensibilización y la hiperreactividad bronquial que resulta de la interacción entre el ozono y los TLR-4 es dependiente de la existencia de ácido hialurónico; sin embargo, los mecanismos no están definidos.42
Mecanismos que promueven la respuesta Th2
Efecto coadyuvante Th2
En los últimos años se demostró que los contaminantes ambientales promueven la respuesta inmunitaria con un perfil Th2. El umbral para que ocurra este proceso variará de una persona a otra debido a su perfil genético.
A causa de la inflamación local ante la exposición a contaminantes, la exposición a alergenos existentes simultáneamente en el aire podría facilitar la entrada de estos últimos en las mucosas, al igual que su manifestación antigénica.43 Díaz y su grupo demostraron en humanos que la inhalación de un antígeno normalmente no alergénico en un medio libre de gases o de partículas de pequeño tamaño induce una respuesta inmunitaria de IgG e IgA; mientras que el mismo antígeno en presencia de partículas de pequeño tamaño y gases como O3, NO y SO2 induce la producción de IgE específica de manera dosis dependiente contra ese antígeno, así como síntomas clínicos, incluso ante exposiciones posteriores del nuevo alergeno sin contaminantes.44,45 De esta manera se demuestra que la exposición a contaminantes puede modificar la respuesta inmunitaria natural a algunos antígenos.
La producción de IgE específica, IgG4 específica y la proliferación de células proinflamatorias que sucede a la exposición a algún alergeno se ve aumentada 50 veces cuando ocurre en presencia de gases y partículas,13 y la bronco-constricción es más severa.46 La exposición de partículas de pequeño tamaño sin alergenos incrementa la producción de IgE en la mucosa nasal, pero no de IgG4, que tiene reconocidas propiedades reguladoras de la respuesta inflamatoria IgE.26,47 En modelos múridos, la inhalación de ovoalbúmina altamente purificada lleva a una tolerancia específica.48 En otros estudios se evaluó la respuesta inmunitaria en ratones, luego de la inoculación de ovoalbúmina y partículas de poliestileno, compuesto insoluble de la superficie de partículas de pequeño tamaño provenientes del humo de cigarrillo y de la combustión de derivados del petróleo; se observó que la IgE y la IgG1 específicas para ovoalbúmina aumentan de manera significativa, en comparación a cuando los ratones se exponen al alergeno solo. En otros experimentos con la misma metodología se replicaron los resultados y se encontró, además, que a las 24 horas de la inoculación, macrófagos con capacidad de tener antígenos vía MHC clase II contenían las partículas de poliestileno, se encontraban en los nódulos linfáticos e inducían un perfil Th2. Al bloquear el receptor CD86 (clouster determination 86 o B7.2) en los macrófagos se detenía la producción de eotaxina (CCL11), de quimiocina derivada de macrófagos (CCL20) y de quimiocina regulada por la activación tímica (CCL17), lo que daba como resultado disminución significativa de la respuesta inflamatoria producida por el humo del diésel, destacándose el papel de estas células en la inflamación mediada por contaminantes.49
Para la estimulación primaria de un linfocito T se requiere su activación por las células dendríticas, que contienen en su membrana abundantes moléculas HLA (antigen human leukocyte), CD86 y CD40. De manera reciente se demostró que las células dendríticas residentes en las vías respiratorias son activadas por el ozono, facilitando la aparición de antígenos a linfocitos T vírgenes.50 Otros contaminantes, como los encontrados en el humo de cigarrillo, también tienen este efecto, porque en los pulmones aumentan las células de Langherhans, que son un fenotipo de células dendríticas mieloides. Una hora después de fumar ocho cigarrillos en un periodo de cuatro horas se observó aumento en la expresión de CD80 y CD86 y la expresión del receptor CCR/7, que promueve la migración de estas células al nódulo linfático y la activación de linfocitos T y B.51
Los contaminantes aéreos, independientemente de si el alergeno existe o no, incrementan la producción de IL-4, IL-5, IL-8 y IL-13, reconocidas citocinas y quimiocinas del perfil Th2 en los pulmones.52 Para el caso de la interleucina 8 y el RANTES (regulated upon activation normal T cell expressed and secreted), se observó que los receptores de los hidrocarburos aromáticos unidos a sus ligandos llevan al aumento de estas quimiocinas por medio de la MAP (mitogen-activeted protein) cinasa p38, que es un importante mediador en las señales que intervienen en la regulación positiva del factor NF-kB y AP-1. La MAP cinasa 38, luego de un estímulo exógeno, fosforila el residuo de serina en la posición 10 de la histona 3 en genes proinflamatorios y lleva al reclutamiento de NF-kB y AP-1 en estos genes y la posterior transcripción de los mismos53 (Figura 2).
Recientemente se demostró el importante papel de los ligandos de hidrocarburos aromáticos en la diferenciación de las células CD4 al perfil Treg o Th17.54-56 Con un ligando (dioxin) se incrementan las células Treg y disminuye la población Th17, mientras que con otro ligando (6-formil indol 3,2-b carbozole FICZ) se aumentan las células Th17 y disminuyen las Treg. Todos estos cambios dependientes del ligando en la población de linfocitos Th17 parecen influir de manera importante en algunos fenotipos de asma.57,58
Mecanismos epigenéticos
Aunque el asma es una enfermedad con un importante componente genético (36 a 79% de heredabilidad), los factores ambientales son determinantes en la manifestación clínica de la enfermedad. Durante los últimos años se identificaron mecanismos epigenéticos inducidos por el ambiente y, más específicamente, por los contaminantes del mismo. De igual manera, las diferentes edades de aparición de la enfermedad y la variabilidad en la gravedad de los síntomas en poblaciones genéticamente similares sugieren la participación de otros mecanismos más dinámicos. Los patrones epigenéticos de una persona pueden modificarse en el curso de la vida, de acuerdo con el tipo de dieta u otros factores, como la contaminación del aire. Los mecanismos más estudiados en el asma son la acetilación de histonas y la metilación de secuencias CpG.59
Acetilación de histonas
La metilación, acetilación, fosforilación y ubiquitinación de las histonas controlan la expresión de los genes por la regulación del acceso de la enzima ARN polimerasa II y de factores de transcripción al ADN.59 Entre estos mecanismos, la acetilación se ha estudiado en el asma y su equilibrio es clave para la correcta transcripción de los genes. Múltiples compuestos existentes en la contaminación atmosférica pueden romper este equilibrio y terminar en una expresión de genes proinflamatorios excesiva en los pulmones. Marwick y colaboradores demostraron en ratones que luego de la exposición durante tres días al humo del cigarrillo, varios aldehídos, como la acroleína y el 4-HNE, pueden producir disminución de la acción de la enzima histona desacetilasa 2 (HDAchi cuadrada) mediante la unión directa a la enzima, lo que lleva a que se mantenga la acetilación de las histonas durante mayor tiempo y también la transcripción de los genes proinflamatorios subyacentes, como IL-4 e IL-13.60 En las biopsias pulmonares de pacientes asmáticos se ha observado que las concentraciones de expresión de enzimas acetiladoras ha aumentado, mientras que las HDAchi cuadrada disminuyeron, en comparación con los pulmones de sujetos sanos.61 Este estado de hiperacetilación de histonas es mayor en sujetos asmáticos que fuman.62
En estudios in vitro se ha observado que el humo del cigarrillo en las células del epitelio bronquial disminuye la acetilación y la metilación de la histona 4 en los residuos de lisina (k) en la posición 16 (H4K16) y H4K20, respectivamente, al tiempo que aumenta la metilación en la histona 3 (H3K2) en los genes DNMT (ADN (citocina-5)-metiltransferasa). Estos genes son importantes en la donación de grupos metil para las secuencias CpG en diferentes puntos del desarrollo embrionario (DNMT3) y durante la infancia (DNMT1). El silenciamiento de DNMT1 y el aumento de la expresión de DNMT3 que ocurre como resultado de los cambios mencionados en sus histonas, luego de la exposición al humo de cigarrillo, lleva a la remodelación bronquial y también se ha asociado con la aparición de cáncer pulmonar.63 En estudios realizados en animales se ha observado que la acetilación o fosforilación de H3K9 y H3K4 promueven la producción de linfocitos Th2, y la expresión de las citocinas IL-5 e IL-13, que forman parte de la respuesta alérgica. Además, estos procesos pueden verse amplificados por el humo de cigarrillo y PM2,5 porque inducen la acetilación de H4K8 y H4K12 al promover la expresión del factor de transcripción NF-κB (nuclear factor kappa B), que al unirse al ADN en genes proinflamatorios, como IL-1 e IL-6, induce la acetilación de los genes subyacentes también con propiedades proinflamatorias.64
Metilación de secuencias CpG
Estudios in vivo con ratones mostraron cambios en la metilación de las secuencias CpG en el gen de la interleucina 4 y el promotor del gen del IFN-g luego de la exposición durante tres semanas a partículas producidas por la combustión del diésel y a Aspergillus fumigatus.65 La exposición sola de diésel no produjo cambios significativos en la metilación, mientras que la exposición sólo a A. fumigatus aumentó levemente la expresión de IL-4; sin embargo, la administración conjunta de diésel y A. fumigatus produjo menor metilación de secuencias CpG en el gen de la IL-4 y mayor en el gen del IFN-g, lo que dio como resultado aumento de la expresión de la IL-4 y disminución de IFN-g.Las concentraciones de IgE más altas también se encontraron con la exposición conjunta de partículas producidas por la combustión del diésel y extracto alergénico (Cuadro 2). En un estudio realizado en el sur de California, con 348 niños, se demostró un patrón específico de metilación en dos elementos repetitivos de ADN (LINE1 y AlyYb8) existentes en varios genes de los niños hijos de madres que fumaron durante el embarazo, lo que indicó que la exposición intrauterina a los contaminantes del aire puede tener efectos a largo plazo, mediados por mecanismos epigenéticos66-68 (Cuadro 2).
| Cuadro 2. Efectos mecánicos de acción de la contaminación ambiental en el asma |
| Efectos |
Efectos y mecanismos de acción de la contaminación ambiental en el asma |
| Acetilación de histonas en neumocitos tipo II |
| Inhibición de fosfatasas de tirosina con prolongación de la fosforilación de NF-kB, ATF2, CJun y CREB |
| Hipermetilación del promotor de INF-g; hipometilación de IL-4 |
| Patrones de metilación específica en secuencias repetitivas LINE 1 y AlyYb8 |
| Aumento de la actividad HAT y disminución de la HDAC2 |
| Modificación de los patrones de metilación in utero |
| Activación de la respuesta de tipo Th2 |
| Mecanismos |
Aumento de la concentración de IgE |
| Aumento de las citocinas IL-13, IL-4, IL-5, IL-8 |
| Aumento de las quimiocinas CCL11, CCL20 y CCL17 |
| Aumento de la activación y proliferación de células presentadoras de antígenos |
| Aumento de la síntesis de radicales libres |
| Mantenimiento de la respuesta inflamatoria pulmonar posnatal |
| NF-kB: factor nuclear KAPPA B; ATF2: factor activador de la transcripción 2; CREB: elemento de unión de respuesta a cAMP. |
En un estudio realizado en Fresno y Stanford (Estados Unidos), Kohli y colaboradores observaron que la exposición pasiva al humo del cigarrillo y a altas concentraciones de contaminantes en el aire aumentaba el riesgo de exacerbaciones bronquiales y la gravedad del asma.69 Al buscar los mecanismos implicados, evaluaron las modificaciones en la metilación en el ADN, secundaria al humo del cigarrillo y los contaminantes del ambiente en los linfocitos T. Los análisis mostraron una asociación entre la exposición al humo del cigarrillo y el aumento en el porcentaje de secuencias CpG metiladas en el gen del INF-γ de los linfocitos T efectores y Foxp3 de los linfocitos T reguladores. Asimismo, la población localizada en Fresno que tenía mayor contaminación, tuvo además mayor metilación de estos genes. Los autores encontraron también una asociación entre estos cambios en el patrón de metilación y las concentraciones de IgE total, especialmente entre los expuestos al humo de cigarrillo. La menor expresión de Foxp3 disminuye la actividad y la proliferación de LT reguladores, mientras que la mayor expresión de INF-g por los LT efectores aumenta la expresión de citoquinas pro-inflamatorias, aumentan el estrés oxidativo y la manifestación antigénica; situaciones que intervienen en la evolución del asma.70
ARN no codificante
El término ARN no codificante es usado comúnmente para moléculas de ARN que no codifican proteínas. Este término incluye ARN de diferentes longitudes que controlan la expresión de genes por diferentes mecanismos. Los microARN se han estudiado en enfermedades pulmonares y pueden controlar la expresión de un gen por medio de la unión al ARN mensajero y su posterior degradación o por la inhibición de la translocación de la proteína. Aunque su efecto en el asma y la contaminación del aire se ha estudiado poco, varios estudios en otras enfermedades, como en la enfermedad pulmonar obstructiva crónica y cáncer pulmonar, sugieren que puede tener un papel importante.
En una revisión realizada en 2015 se observó que 27 microARN se asociaron en al menos dos estudios cada uno, con cambios en la expresión de múltiples genes luego de la inhalación de humo de cigarrillo; estos cambios consistían principalmente en la degradación del ARN mensajero expresado por genes antiinflamatorios (IL-10, INF- γ),71 lo que aumenta indirectamente la expresión de genes proinflamatorios (IL-1, IL-6, IL-17). Zhou y su grupo observaron que las partículas producidas por la combustión del diésel incrementan la expresión de miR-21, que lleva a la activación de la vía proinflamatoria PTEN/P13/AKT en células bronquiales humanas, lo que en sentido clínico puede terminar en hiperreactividad bronquial y remodelación bronquial, si la exposición es corta, o en cáncer, si la exposición es prolongada.72
Acción de las partículas de pequeño tamaño como vehículos de alergenos
Los alergenos del polen (Lol p 1), ácaros (Der p 1) y de mascotas (Fel d 1) pueden unirse fuertemente a las PM<10 y PM<2.573,74 debido a que el centro de carbono de estas partículas facilita estas uniones por fuerzas electrostáticas; por su tamaño y peso, las PM2.5 son transportadas con la inhalación a las vías respiratorias inferiores de manera más efectiva que los alergenos solos. Junto con los alergenos en la superficie de partículas de pequeño tamaño van adheridas endotoxinas y muchos de los compuestos químicos irritativos mencionados, lo que forma un medio que estimula la respuesta inflamatoria; sin embargo, la unión física no parece ser indispensable porque la inhalación de las partículas, junto con los alergenos aun sin estar adheridos, parece producir el mismo resultado (Figura 3).
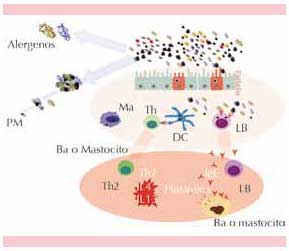
Figura 3. Partículas de pequeño tamaño como vehículos de los alergenos. Las partículas pueden adherir en su superficie diferentes alergenos, por efecto electroestático, lo que facilita su paso a las vías aéreas inferiores. Cuando ya están en los alvéolos, las partículas, por diversos mecanismos, aumentan una respuesta Th2 y el número de células presentadoras de antígenos, así como la producción de IgE. Además, lesionan las células del epitelio alveolar, lo que permite el paso de más alergenos. PM: partículas de pequeño tamaño; Ma: macrófagos; Th: linfocitos T ayudadores; DC: células dendríticas; LB: linfocitos B; Ba: basófilos; IL: interleucina; IgE: inmunoglobulina E.
Efecto de la contaminación en las fuentes de alergenos
Además de los efectos directos de los contaminantes en el aire en la respuesta inmunológica y el efecto irritativo en los pulmones, los contaminantes inducen la respuesta Th2 mediante la síntesis de alergenos en diferentes fuentes.
Se ha demostrado en cultivos de avena, centeno y en granos de polen que la exposición a concentraciones elevadas de ozono, CO2, NO, SO2 y metales pesados aumenta la fotosíntesis y la expresión de proteínas con capacidad alergénica.4,75 Asimismo, los contaminantes asociados con otros factores, como la humedad y la temperatura, pueden llevar a cambios estructurales en los alergenos que modifican su capacidad de activar una respuesta Th2, así como su volatilidad, lo que facilita la exposición a sus granos.76
Entre los mecanismos que parecen explicar este efecto de los contaminantes está la nitración de las proteínas, que consiste en la unión de radicales nitrilos a algunos aminoácidos, y modifica la estructura de la proteína, lo que las hace más fácilmente reconocidas por las células dendríticas y éstas, a su vez, al estar activadas promueven la manifestación antigénica a linfocitos Th2, con su consecuente proliferación.77
Aspectos genéticos
Los estudios genéticos basados en familias o estudios de casos y controles han permitido identificar varios genes asociados con enfermedades alérgicas y atopia, muchos de ellos podrían controlar la susceptibilidad del pulmón y del sistema inmunitario a la exposición de O3, NO2, SO2 y partículas de pequeño tamaño.78,79
Entre los gases, el ozono es el que más atención tuvo en los últimos años, en la búsqueda de genes que expliquen la variabilidad en la respuesta de cada individuo. Kleeberger y colaboradores estudiaron un modelo de roedores resultado del cruce entre ratones C57BL/6J (B6) y C3H/HeJ (C3), que son susceptibles y resistentes, respectivamente, a la inflamación, luego de la exposición a O3.80 El mapeo del genoma de estos ratones permitió la identificación de segmentos QTL (quantitative trait locus), susceptibles en el cromosoma 17 y un segmento sugerente en el cromosoma 11; entre los genes existentes en el segmento del cromosoma 17 está el factor de necrosis tumoral alfa (TNF-α).81 Estudios posteriores que evaluaron el efecto de eliminaciones en el gen del receptor del TNF-a y la asociación del gen con la respuesta al O3 en otras cepas de ratones reafirmaron al TNF-a como un gen con un papel clave ante la respuesta al ozono.
En los seres humanos, el SO2 produce una broncoconstricción en concentraciones superiores a 0.14 ppm durante 24 horas. Sin embargo, en la mayoría de los sujetos asmáticos existe una considerable disminución en la capacidad ventilatoria ante la inhalación de SO2 en concentraciones menores a 0.14 ppm.82 Winterton y colaboradores evaluaron el volumen espiratorio forzado de 62 sujetos asmáticos y estudiaron siete polimorfismos en cinco genes frente a la exposición de 0.5 ppm durante sólo 10 minutos con SO2.83 Encontraron asociación de una variante silvestre (wild type) en el promotor TNF-a con la disminución del volumen espiratorio forzado, luego de la exposición a SO2. Al igual que con el ozono, el TNF-a parece ser un gen importante en regular la respuesta para SO2 y posiblemente para otros contaminantes ambientales.
Ohtsuka y su grupo realizaron un rastreo genómico en ratones B6C3F2, que son el cruce de ratones B6 y C3.84 Estos ratones se expusieron a partículas de carbono y se identificaron 2 segmentos QTL susceptibles para la respuesta inflamatoria ante la exposición con partículas de pequeño tamaño: uno en el cromosoma 17 y otro en el cromosoma 11, que están superpuestos con los encontrados en los ensayos con el ozono.85
Los genes que codifican para los receptores toll like (TLR) también se asocian con la respuesta al ozono. Kleeberger estudió las diferencias en la permeabilidad alveolar inducida con exposiciones de ozono a una concentración de 0.3 ppm en diferentes cepas de ratones.78,86 Identificó un segmento en el cromosoma 4 que contiene el gen Tlr4 y se evaluaron las concentraciones de ARN mensajero de TLR-4 existente en la cepa de ratones C3H/Hej (Hej) y C3H/HeOuj (OuJ). La única diferencia genética entre estas cepas de ratones era un polimorfismo de un solo nucleótido (SNP) en la región codificadora de Tlr4. Las mayores concentraciones de ARN mensajero de TLR-4, luego de la exposición con ozono se encontraron en el ratón OuJ, que son homocigotos para el alelo silvestre, y estos ratones también tenían las mayores concentraciones de proteínas en el lavado bronquio-alveolar, luego de la exposición. Resultados similares se han encontrado con partículas de pequeño tamaño y componentes orgánicos volátiles.87
En ratones expuestos a óxido de cinc se identificaron varios locus de caracteres cuantitativos asociados con asma en el cromosoma 1; entre los genes localizados en esa región está el gen para el receptor toll like 5 (TLR-5).88 Estas asociaciones muestran que los receptores toll like, debido a su actividad en la respuesta innata y su acción como receptores de señales del ambiente, podrían tener un papel importante en la respuesta a los contaminantes aéreos.
Las enzimas antioxidantes tienen gran importancia como reguladoras en la respuesta frente a contaminantes; por ello, el estudio de sus genes es de gran interés. La GST es una enzima antioxidante y se han identificado cuatro clases citosólicas; Alpha (A), Mu (M), Pi (P) y Theta (T); cada una con diferentes subclases.89 En el epitelio pulmonar humano, la GSTP1 contribuye con 90% de la actividad de esta enzima. Varios estudios demostraron que variantes genéticas comunes de GSTM1 y GSTP1 influyen la respuesta alérgica y el estado de atopia.90-93 Gilliland y colaboradores estudiaron si algunos genotipos de GSTM1 y GSTP1 contribuyen en el incremento de la respuesta alérgica; en 19 personas con asma y rinitis alérgica aplicaron un modelo de reto nasal con alergeno, aire limpio y humo de cigarrillo.93 Los resultados mostraron que los pacientes con el genotipo nulo para GSTM1 tenían mayores concentraciones de IgE y los sujetos homocigotos para GSTP1 Ile 105 (Ile105 - Val105) tenían mayores concentraciones de histamina cuando estaban expuestos al humo de cigarrillo o al alergeno que los sujetos con otros genotipos; los sujetos con los genotipos proinflamatorios mostraron la mayor elevación de IgE y de histamina. Romieu y su grupo, en una población de niños encontraron resultados similares ante la exposición con ozono.94 Otros estudios mostraron que estos polimorfismos en el gen de la GST-P1 y de la GSTM1 también tienen una fuerte asociación con varios fenotipos de asma e hiperreactividad bronquial después de la exposición a NO y SO2.91,95
En México, en una cohorte de 151 niños asmáticos se observó que los niños con el genotipo nulo para GSTM1 tenían disminución en el flujo espiratorio forzado máximo (FEF25-75) en las zonas de la ciudad con mayor contaminación. También se encontró que la complementación con vitaminas antioxidantes podía mejorar la función respiratoria en niños con el genotipo nulo, pero no mostraba cambios en los niños con GSTM1 existente; se indicó que el beneficio de esta complementación dependería de factores genéticos que determinan el estrés oxidativo y, de esta manera, la función pulmonar.94,96,97
En la Figura 4 se resumen algunos genes que hasta el momento se han vinculado con el asma alérgica y con la contaminación ambiental.
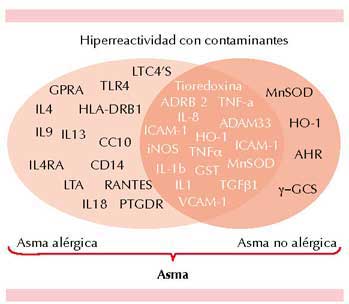
Figura 4. Algunos genes asociados con asma y con contaminantes. Se muestran los genes que se han asociado con el asma y también con síntomas respiratorios por contaminantes. En la actualidad, un gran número de genes se han identificado, y se ha mostrado que los contaminantes son un importante factor en el asma alérgica y no alérgica.
CONCLUSIÓN
Los estudios realizados hasta el momento, en ratones y en humanos, han descubierto varios mecanismos acerca de cómo los contaminantes aumentan las crisis de asma, ya sea por su efecto irritante o por una respuesta Th2 con la participación del sistema inmunitario innato y adaptativo. La mayor parte de los polimorfismos asociado con inflamación pulmonar por contaminantes atmosféricos también se han asociado con la evolución de alergias y mayor número de exacerbaciones de asma (Cuadro 3). Estos resultados demuestran claramente que los contaminantes pueden intervenir en el origen del asma, directa e indirectamente, y en sus exacerbaciones; sin embargo, se necesitan más investigaciones acerca del efecto de los contaminantes entre las diferentes poblaciones para crear estrategias de tratamiento y prevención de acuerdo con las condiciones de cada región, que permitan disminuir el número de exacerbaciones y de nuevos casos de asma.
| Cuadro 3. Puntos clave y resumen de la revisión |
| 1. |
La contaminación del aire influye en el origen y la evolución de las enfermedades respiratorias |
| 2. |
El incremento en la frecuencia que ha tenido el asma en los últimos años se asocia con el aumento de múltiples contaminantes atmosféricos, como NO2, SO2, CO, O3 y partículas de pequeño tamaño |
| 3. |
Estudios en humanos demuestran el efecto irritativo de varios contaminantes y su relación con el aumento de las exacerbaciones del asma |
| 4. |
Experimentos in vivo e in vitro demuestran que los contaminantes pueden tener efectos epigenéticos en la acetilación de histonas y en la metilación de secuencias CpG |
| 5. |
Varios polimorfismos en humanos se han asociado con el asma y con mayor sensibilidad al efecto de los contaminantes |
REFERENCIAS
- Dennis R, Caraballo L, Garcia E, Caballero A, et al. Asthma and other allergic conditions in Colombia: a study in 6 cities. Ann Allergy Asthma Immunol 2004;93:568-574.
- Anandan C, Nurmatov U, van Schayck O, Sheikh A. Is the prevalence of asthma declining? Systematic review of epidemiological studies. Allergy 2010;65:152-167.
- Dennis RJ, Caraballo L, García E, Rojas MX, et al. Prevalence of asthma and other allergic conditions in Colombia 2009-2010: a cross-sectional study. BMC Pulm Med 2012;12:17.
- Sanchez J. Physicochemical characteristics of gaseous and particulate air pollutants. Their impact on asthma. Iatreia 2012;25:369-379.
- Caraballo L, Puerta L, Martinez B, Moreno L. Identification of allergens from the mite Blomia tropicalis. Clin Exp Allergy 1994;24:1056-1060.
- Puerta L, Fernandez-Caldas E, Mercado D, Lockey RF, Caraballo LR. Sequential determinations of Blomia tropicalis allergens in mattress and floor dust samples in a tropical city. J Allergy Clin Immunol 1996;97:689-691.
- Fernandez-Caldas E, Puerta L, Mercado D, Lockey RF, Caraballo LR. Mite fauna, Der p I, Der f I and Blomia tropicalis allergen levels in a tropical environment. Clin Exp Allergy 1993;23:292-297.
- Fernandez-Caldas E, Puerta L, Caraballo L, Mercado D, Lockey RF. Sequential determinations of Dermatophagoides spp. allergens in a tropical city. J Investig Allergol Clin Immunol 1996;6:98-102.
- Heinrich J, Wichmann HE. Traffic related pollutants in Europe and their effect on allergic disease. Curr Opin Allergy Clin Immunol 2004;4:341-348.
- 10. Trenga CA, Sullivan JH, Schildcrout JS, Shepherd KP, et al. Effect of particulate air pollution on lung function in adult and pediatric subjects in a Seattle panel study. Chest 2006;129:1614-1622.
- Anderson H, Ruggles R, Pandey K, Kapetanakis V, et al. Ambient particulate pollution and the world-wide prevalence of asthma, rhinoconjunctivitis and eczema in children: Phase One of the International Study of Asthma and Allergies in Childhood (ISAAC). Occup Environ Med 2010;67:293-300.
- Sánchez J, Urrego J, Zakzuk J, Bornacelly A, et al. Niveles de contaminantes en el aire de Cartagena, Colombia. Revista Salud UIS 2013;45:35-44.
- Poynter ME, Persinger RL, Irvin CG, Butnor KJ, et al. Nitrogen dioxide enhances allergic airway inflammation and hyperresponsiveness in the mouse. Am J Physiol Lung Cell Mol Physiol 2006;290:144-152.
- Babin SM, Burkom HS, Holtry RS, Tabernero NR, et al. Pediatric patient asthma-related emergency department visits and admissions in Washington, DC, from 2001-2004, and associations with air quality, socio-economic status and age group. Environ Health 2007;6:9.
- Villeneuve PJ, Chen L, Rowe BH, Coates F. Outdoor air pollution and emergency department visits for asthma among children and adults: a case-crossover study in northern Alberta, Canada. Environ Health 2007;6:40.
- Tecer LH, Alagha O, Karaca F, Tuncel G, Eldes N. Particulate matter (PM(2.5), PM(10-2.5), and PM(10)) and children’s hospital admissions for asthma and respiratory diseases: a bidirectional case-crossover study. J Toxicol Environ Health A 2008;71:512-520.
- Khalequzzaman M, Kamijima M, Sakai K, Chowdhury NA, et al. Indoor air pollution and its impact on children under five years old in Bangladesh. Indoor Air 2007;17:297-304.
- Brauer M, Hoek G, Smit HA, de Jongste JC, et al. Air pollution and development of asthma, allergy and infections in a birth cohort. Eur Respir J 2007;29:879-888.
- Skorge TD, Eagan TM, Eide GE, Gulsvik A, Bakke PS. The adult incidence of asthma and respiratory symptoms by passive smoking in uterus or in childhood. Am J Respir Crit Care Med 2005;172:61-66.
- Pinkerton KE, Joad JP. Influence of air pollution on respiratory health during perinatal development. Clin Exp Pharmacol Physiol 2006;33:269-272.
- Saxon A, Diaz-Sanchez D. Air pollution and allergy: you are what you breathe. Nat Immunol 2005;6:223-226.
- Solarte I. Contaminación ambiental, cigarrillos y asma. In: Madrid ÁG, editor. Asma. 1ª Ed. Editorial Panamericana 2005;287-96.
- Holtzman MJ, Byers DE, Alexander-Brett J, Wang X. The role of airway epithelial cells and innate immune cells in chronic respiratory disease. Nat Rev Immunol 2014;14:686-698.
- Keller AC, Rodriguez D, Russo M. Nitric oxide paradox in asthma. Mem Inst Oswaldo Cruz 2005;100:19-23.
- Anderson SE, Wells JR, Fedorowicz A, Butterworth LF, et al. Evaluation of the contact and respiratory sensitization potential of volatile organic compounds generated by simulated indoor air chemistry. Toxicol Sci 2007;97:355-363.
- Nygaard UC, Ormstad H, Aase A, Løvik M. The IgE adjuvant effect of particles: characterisation of the primary cellular response in the draining lymph node. Toxicology 2005;206:181-193.
- Samuelsen M, Nygaard UC, Lovik M. Allergy adjuvant effect of particles from wood smoke and road traffic. Toxicology 2008;246:124-131.
- Pandya RJ, Solomon G, Kinner A, Balmes JR. Diesel exhaust and asthma: hypotheses and molecular mechanisms of action. Environ Health Perspect 2002;110:103-112.
- Leikauf GD. Hazardous air pollutants and asthma. Environ Health Perspect 2002;110:505-526.
- Hayes J, Strange RC. Potential contribution of the glutathione S-transferase supergene family to resistance to oxidative stress. Free Radic Res 1995;22:193-207.
- Lim HB, Ichinose T, Miyabara Y, Takano H, et al. Involvement of superoxide and nitric oxide on airway inflammation and hyperresponsiveness induced by diesel exhaust particles in mice. Free Radic Biol Med 1998;25:635-644.
- Li N, Xia T, Nel AE. The role of oxidative stress in ambient particulate matter-induced lung diseases and its implications in the toxicity of engineered nanoparticles. Free Radic Biol Med 2008;44:1689-1699.
- Fakhrzadeh L, Laskin JD, Laskin DL. Ozone-induced production of nitric oxide and TNF-alpha and tissue injury are dependent on NF-kappaB p50. Am J Physiol Lung Cell Mol Physiol 2004;287:279-285.
- Cho HY, Zhang LY, Kleeberger SR. Ozone-induced lung inflammation and hyperreactivity are mediated via tumor necrosis factor-alpha receptors. Am J Physiol Lung Cell Mol Physiol 2001;280:537-546.
- Cho HY, Morgan DL, Bauer AK, Kleeberger SR. Signal transduction pathways of tumor necrosis factor–mediated lung injury induced by ozone in mice. Am J Respir Crit Care Med 2007;175:829-839.
- Kleeberger SR, Reddy SP, Zhang LY, Cho HY, Jedlicka AE. Toll-like receptor 4 mediates ozone-induced murine lung hyperpermeability via inducible nitric oxide synthase. Am J Physiol Lung Cell Mol Physiol 2001;280:326-333.
- Dong L, Li H, Wang S, Li Y. Different doses of lipopolysaccharides regulate the lung inflammation of asthmatic mice via TLR4 pathway in alveolar macrophages. J Asthma 2009;46:229-233.
- Arif A, Shah SM. Association between personal exposure to volatile organic compounds and asthma among US adult population. Int Arch Occup Environ Health 2007;80:711-719.
- Abe S, Takizawa H, Sugawara I, Kudoh S. Diesel exhaust (DE)-induced cytokine expression in human bronchial epithelial cells: a study with a new cell exposure system to freshly generated DE in vitro. Am J Respir Cell Mol Biol 2000;22:296-303.
- Eisenbarth S, Piggott D, Huleatt J, Visintin I, et al. Lipopolysaccharide-enhanced, toll-like receptor 4-dependent T helper cell type 2 responses to inhaled antigen. J Exp Med 2002;196:1645-1651.
- Hollingsworth J, Free M, Li Z, Andrews L, et al. Ozone activates pulmonary dendritic cells and promotes allergic sensitization through a Toll-like receptor 4-dependent mechanism. J Allergy Clin Immunol 2010;125:1167-1170.
- Garantziotis S, Li Z, Potts E, Lindsey J, et al. TLR4 is necessary for hyaluronan-mediated airway hyperresponsiveness after ozone inhalation. Am J Respir Crit Care Med 2010;181:666-675.
- Larsen ST, Matsubara S, McConville G, Poulsen S, Gelfand E. Ozone increases airway hyperreactivity and mucus hyperproduction in mice previously exposed to allergen. J Toxicol Environ Health A 2010;73:738-747.
- Diaz-Sanchez D, Garcia MP, Wang M, Jyrala M, Saxon A. Nasal challenge with diesel exhaust particles can induce sensitization to a neoallergen in the human mucosa. J Allergy Clin Immunol 1999;104:1183-1188.
- Diaz-Sanchez D, Tsien A, Fleming J, Saxon A. Combined diesel exhaust particulate and ragweed allergen challenge markedly enhances human in vivo nasal ragweed-specific IgE and skews cytokine production to a T helper cell 2-type pattern. J Immunol 1997;158:2406-2413.
- Diaz-Sanchez D, Dotson AR, Takenaka H, Saxon A. Diesel exhaust particles induce local IgE production in vivo and alter the pattern of IgE messenger RNA isoforms. J Clin Invest 1994;94:1417-1425.
- Nygaard UC, Aase A, Lovik M. The allergy adjuvant effect of particles-genetic factors influence antibody and cytokine responses. BMC Immunol 2005;6:11.
- Akbari O, DeKruyff R, Umetsu D. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen. Nat Immunol 2001;2:725-731.
- Fahy O, Senechal S, Pène J, Scherpereel A, et al. Diesel exposure favors Th2 cell recruitment by mononuclear cells and alveolar macrophages from allergic patients by differentially regulating macrophage-derived chemokine and IFN-gamma-induced protein-10 production. J Immunol 2002;168:5912-5919.
- Alexis NE, Zhou H, Lay JC, Harris B, et al. The glutathione-S-transferase Mu 1 null genotype modulates ozone-induced airway inflammation in human subjects. J Allergy Clin Immunol 2009;124:1222-1228.
- Lommatzsch M, Bratke K, Knappe T, Bier A, et al. Acute effects of tobacco smoke on human airway dendritic cells in vivo. Eur Respir J 2010;35:1130-1136.
- Sénéchal S, de Nadai P, Ralainirina N, Scherpereel A, et al. Effect of diesel on chemokines and chemokine receptors involved in helper T cell type 1/type 2 recruitment in patients with asthma. Am J Respir Crit Care Med 2003;168:215-221.
- Le Bellego F, Plante S, Chakir J, Hamid Q, Ludwig MS. Differences in MAP kinase phosphorylation in response to mechanical strain in asthmatic fibroblasts. Respir Res 2006;7:68.
- Quintana FJ, Basso AS, Iglesias AH, Korn T, et al. Control of T(reg) and T(H)17 cell differentiation by the aryl hydrocarbon receptor. Nature 2008;453:65-71.
- Veldhoen M, Hirota K, Westendorf AM, Buer J, et al. The aryl hydrocarbon receptor links T(H)17-cell-mediated autoimmunity to environmental toxins. Nature 2008;453:106-109.
- Stevens EA, Bradfield CA. Immunology: T cells hang in the balance. Nature 2008;453:46-47.
- Wilson RH, Whitehead GS, Nakano H, Free ME, et al. Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness. Am J Respir Crit Care Med 2009;180:720-730.
- Krishnamoorthy N, Oriss TB, Paglia M, Fei M, et al. Activation of c-Kit in dendritic cells regulates T helper cell differentiation and allergic asthma. Nat Med 2008;14:565-573.
- VC. Epigenetics in asthma. Iatreia 2009;22:359-271.
- Marwick JA, Kirkham PA, Stevenson CS, Danahay H, et al. Cigarette smoke alters chromatin remodeling and induces proinflammatory genes in rat lungs. Am J Respir Cell Mol Biol 2004;31:633-642.
- Ito K, Caramori G, Lim S, Oates T, et al. Expression and activity of histone deacetylases in human asthmatic airways. Am J Respir Crit Care Med 2002;166:392-396.
- Adcock IM, Ford P, Ito K, Barnes PJ. Epigenetics and airways disease. Respir Res 2006;7:21.
- Liu F, Killian JK, Yang M, Walker RL, et al. Epigenomic alterations and gene expression profiles in respiratory epithelia exposed to cigarette smoke condensate. Oncogene 2010;29:3650-3664.
- Yang IV, Schwartz DA. Epigenetic mechanisms and the development of asthma. J Allergy Clin Immunol 2012;130:1243-1255.
- Liu J, Ballaney M, Al-alem U, Quan C, et al. Combined inhaled diesel exhaust particles and allergen exposure alter methylation of T helper genes and IgE production in vivo. Toxicol Sci 2008;102:76-81.
- Breton C, Byun H, Wenten M, Pan F, et al. Prenatal tobacco smoke exposure affects global and gene-specific DNA methylation. Am J Respir Crit Care Med 2009;180:462-467.
- Jiang R, Jones MJ, Sava F, Kobor MS, Carlsten C. Short-term diesel exhaust inhalation in a controlled human crossover study is associated with changes in DNA methylation of circulating mononuclear cells in asthmatics. Part Fibre Toxicol 2014;11:71.
- Borgie M, Ledoux F, Verdin A, Cazier F, et al. Genotoxic and epigenotoxic effects of fine particulate matter from rural and urban sites in Lebanon on human bronchial epithelial cells. Environ Res 2015;136:352-362.
- Kohli A, Garcia MA, Miller RL, Maher C, et al. Secondhand smoke in combination with ambient air pollution exposure is associated with increasedx CpG methylation and decreased expression of IFN-γ in T effector cells and Foxp3 in T regulatory cells in children. Clin Epigenetics 2012;4:17.
- Hew KM, Walker AI, Kohli A, Garcia M, et al. Childhood exposure to ambient polycyclic aromatic hydrocarbons is linked to epigenetic modifications and impaired systemic immunity in T cells. Clin Exp Allergy 2015;45:238-248.
- Vrijens K, Bollati V, Nawrot TS. MicroRNAs as potential signatures of environmental exposure or effect: a systematic review. Environ Health Perspect 2015;123:399-411.
- Zhou F, Li S, Jia W, Lv G, et al. Effects of diesel exhaust particles on microRNA-21 in human bronchial epithelial cells and potential carcinogenic mechanisms. Mol Med Rep 2015;12:2329-2335.
- Knox RB, Suphioglu C, Taylor P, Desai R, et al. Major grass pollen allergen Lol p 1 binds to diesel exhaust particles: implications for asthma and air pollution. Clin Exp Allergy 1997;27:246-251.
- Ormstad H. Suspended particulate matter in indoor air: adjuvants and allergen carriers. Toxicology 2000;152:53-68.
- Yeh KW, Chang CJ, Huang JL. The association of seasonal variations of asthma hospitalization with air pollution among children in Taiwan. Asian Pac J Allergy Immunol 2011;29:34-41.
- Behrendt H, Becker WM, Fritzsche C, Sliwa-Tomczok W, et al. Air pollution and allergy: experimental studies on modulation of allergen release from pollen by air pollutants. Int Arch Allergy Immunol 1997;113:69-74.
- Ackaert C, Kofler S, Horejs-Hoeck J, Zulehner N, et al. The impact of nitration on the structure and immunogenicity of the major birch pollen allergen Bet v 1.0101. PLoS One 2014;9:104520.
- Kleeberger SR. Genetic aspects of pulmonary responses to inhaled pollutants. Exp Toxicol Pathol 2005;57:147-153.
- Kleeberger SR. Genetic aspects of susceptibility to air pollution. Eur Respir J Suppl 2003;40:52-56.
- Kleeberger SR, Levitt RC, Zhang LY, Longphre M, et al. Linkage analysis of susceptibility to ozone-induced lung inflammation in inbred mice. Nat Genet 1997;17:475-478.
- Cho HY, Zhang LY, Kleeberger SR. Ozone-induced lung inflammation and hyperreactivity are mediated via tumor necrosis factor-a receptors. Am J Physiol Lung Cel Mol Physiol 2001;280:537.
- Bernstein JA, Alexis N, Barnes C, Bernstein IL, et al. Health effects of air pollution. J Allergy Clin Immunol 2004;114:1116-1123.
- Winterton DL, Kaufman J, Keener CV, Quigley S, et al. Genetic polymorphisms as biomarkers of sensitivity to inhaled sulfur dioxide in subjects with asthma. Ann Allergy Asthma Immunol 2001;86:232-238.
- Ohtsuka Y, Brunson KJ, Jedlicka AE, Mitzner W, et al. Genetic linkage analysis of susceptibility to particle exposure in mice. Am J Respir Cell Mol Biol 2000;22:574-581.
- Ohtsuka Y, Clarke RW, Mitzner W, Brunson K, et al. Interstrain variation in murine susceptibility to inhaled acid-coated particles. Am J Physiol Lung Cell Mol Physiol 2000;278:469-476.
- Kleeberger SR, Reddy S, Zhang LY, Jedlicka AE. Genetic susceptibility to ozone-induced lung hyperpermeability: role of toll-like receptor 4. Am J Respir Cell Mol Biol 2000;22:620-627.
- Cho HY, Jedlicka AE, Clarke R, Kleeberger SR. Role of Toll-like receptor-4 in genetic susceptibility to lung injury induced by residual oil fly ash. Physiol Genomics 2005;22:108-117.
- Wesselkamper SC, Chen LC, Gordon T. Quantitative trait analysis of the development of pulmonary tolerance to inhaled zinc oxide in mice. Respir Res 2005;6:73.
- von Mutius E, Le Souëf PN. Early gene-environment interactions: can they inform primary preventive strategies for asthma? Semin Respir Crit Care Med 2007;28:255-263.
- Gilliland FD, Li YF, Saxon A, Diaz-Sanchez D. Effect of glutathione-S-transferase M1 and P1 genotypes on xenobiotic enhancement of allergic responses: randomised, placebo-controlled crossover study. Lancet 2004;363:119-125.
- Lee YL, Lin YC, Lee YC, Wang JY, et al. Glutathione S-transferase P1 gene polymorphism and air pollution as interactive risk factors for childhood asthma. Clin Exp Allergy 2004;34:1707-1713.
- Kabesch M, Hoefler C, Carr D, Leupold W, et al. Glutathione S transferase deficiency and passive smoking increase childhood asthma. Thorax 2004;59:569-573.
- Gilliland FD, Li YF, Gong H Jr., Diaz-Sanchez D. Glutathione s-transferases M1 and P1 prevent aggravation of allergic responses by secondhand smoke. Am J Respir Crit Care Med 2006;174:1335-1341.
- Romieu I, Ramirez-Aguilar M, Sienra-Monge JJ, Moreno-Macias H, et al. GSTM1 and GSTP1 and respiratory health in asthmatic children exposed to ozone. Eur Respir J 2006;28:953-959.
- Islam T, Berhane K, McConnell R, Gauderman W, et al. Glutathione-S-transferase (GST) P1, GSTM1, exercise, ozone and asthma incidence in school children. Thorax 2009;64:197-202.
- London SJ. Gene-air pollution interactions in asthma. Proc Am Thorac Soc 2007;4:217-220.
- Romieu I, Meneses F, Ramirez M, Ruiz S, et al. Antioxidant supplementation and respiratory functions among workers exposed to high levels of ozone. Am J Respir Crit Care Med 1998;158:226-232.



